
【题目】碱性锌锰干电池在放电时,电池的总反应方程式可以表示为: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。电池放电时,负极上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
试题分析:根据总反应方程式可知Zn在反应中失去电子,发生氧化反应,所以作原电池的负极,MnO2得到电子,发生还原反应,作原电池的正极。因此答案是选项A。
考点:考查根据原电池反应原理确定电池的电极材料的知识
【题型】单选题
【结束】
17
【题目】在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
【答案】C
【解析】①1mol N≡N键断裂的同时,有6mol N-H键断裂,说明正逆反应速率相等,反应达到了平衡状态,故①选;②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1,因未说明二者表示的是正反应速率还是逆反应速率,则不能说明正逆反应速率相等,反应不一定达到平衡状态,故②不选;③根据质量守恒可知,该反应在反应前后质量不变,又因容器恒容,所以反应体系的密度始终不变,则体系气体密度不再改变不能说明反应达到平衡状态,故③不选;④NH3、N2、H2的体积分数都不再改变,说明正逆反应速率相等,反应达到了平衡状态,故④选;⑤因该反应是在恒容隔热容器中进行,则体系温度不再改变,说明反应达到了平衡状态,故⑤选,综上所述,答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(题文)海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请填写下列空白:
(1)步骤③和⑤的实验操作名称分别是________________、____________。
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是________,该装置的操作名称为__________。
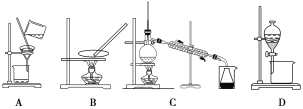
(3)步骤④反应的离子方程式是___________________________。
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质](15 分)
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3等。
回答下列问题:
(1) UF4用Mg或Ca 还原可得金属铀。基态钙原子的核外电子排布式为__________________;熔点:MgO(2852℃)高于CaO(2614℃),原因是_______________________________;金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为_______________________________。
(2)已知:2UO2+5NH4HF2 ![]() 2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
a.氢键 b.配位键 c.共价键 d.离子键 e.金属键
(3)已知:3[(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
①NH4+的空间构型为_____________________,与NH4+互为等电子体的分子或离子有_____(任写两种)。
②CO32-中碳原子的杂化轨道类型为___________________________。
③分解产物中属于非极性分子的是____________________(填选项字母)。
a.NH3 b. CO2 C.N2 d. H2O
(4)UO2的晶胞结构及晶胞参数如图所示:
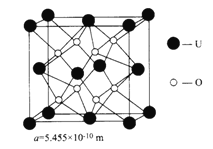
①晶胞中U 的配位数为__________________________。
②UO2晶体的密度为_____________g·cm-3(列出计算式即可。设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.链节是高分子化合物中重复出现的结构单元,如聚乙烯的链节是CH2=CH2
B.丙烯和聚丙烯都能使溴水褪色
C.高分子化合物没有固定的熔沸点
D.加聚反应生存环境高分子化合物的同时,还有H2O等小分子物质生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是 ( )
A. 纯碱溶于热水后去污效果增强,说明纯碱的水解反应是吸热反应
B. NH3(g) + HCl(g) = NH4Cl(s) 在较低温度下能自发进行,说明该反应的ΔH>0
C. 500℃、30 MPa下,将7 g N2和3 g H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的燃烧热(ΔH)为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
【答案】A
【解析】A. 纯碱溶于热水后去污效果增强,说明升高温度促进了水解,使水解平衡正向移动,所以可以说明纯碱的水解是吸热反应,故A正确;B. 根据△G=△H-T△S可知,当△G小于0时反应自发进行,由于反应NH3(g) + HCl(g) = NH4Cl(s)是熵值减小的反应,所以如果该反应在较低温度下能自发进行,则说明该反应的△H<0,故B错误;C.因合成氨的反应是可逆反应,所以无法确定将7 g N2和3 g H2置于密闭容器中充分反应后,生成了多少NH3(g),故无法计算该反应的焓变,故C错误;D. 燃烧热指的是1mol纯物质完全燃烧生成稳定的氧化物时所放出的能量,所以生成的水应为液态,即甲烷燃烧的热化学方程式应表示为CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,故D错误;答案选A。
【题型】单选题
【结束】
14
【题目】在0.1 mol·L-1的CH3COOH溶液中,要抑制醋酸电离,且c(H+)增大,应采取的措施是
A. 加水 B. 升温 C. 加适量CH3COONa固体 D. 通适量HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有a.BaCl2 b.金刚石 c.NH4Cl d.Na2SO4 e.干冰 f.碘片六种物质,按下列要求回答(若有多个选项的,多选错选不给分):
①熔化时需要破坏共价键的是______, 熔点最高的是_______,熔点最低的是_______。
②属于离子化合物的是________,只含有离子键的物质是________,含有两种化学键的物质是_________,含有分子间作用力的是__________。
(2)看下图回答下列问题
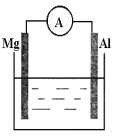
①若烧杯中溶液为稀硫酸,则观察到的现象是___________,负极反应式为___________。
②若烧杯中溶液为氢氧化钠溶液,则负极为_______(填Mg或Al),总反应方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
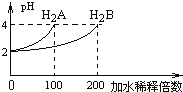
A. H2A为二元弱酸,稀释前c(H2A)=0.005mol/L
B. NaHA水溶液中:c(Na+)+ c(H+)= 2c(A2-)+ c(OH-)
C. 含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2-)+ c(B2-)+ c(HB-)+ c(H2B)
D. pH=10的NaHB溶液中,离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨(NH2OH )为一元弱碱(25℃时,电高常数Kb=9.0×10-9),其电离方程式为NH2OH+H2O ![]() NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是( )
NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是( )
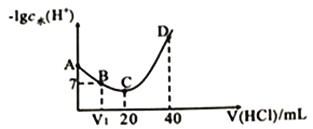
A. V1<10
B. A点对应溶液的pH=9.5
C. A 、B、C 、D四点对应的溶液中NH2OH电离常数相等
D. D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com