
【题目】[化学一选修3:物质结构与性质](15 分)
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3等。
回答下列问题:
(1) UF4用Mg或Ca 还原可得金属铀。基态钙原子的核外电子排布式为__________________;熔点:MgO(2852℃)高于CaO(2614℃),原因是_______________________________;金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为_______________________________。
(2)已知:2UO2+5NH4HF2 ![]() 2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
a.氢键 b.配位键 c.共价键 d.离子键 e.金属键
(3)已知:3[(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
①NH4+的空间构型为_____________________,与NH4+互为等电子体的分子或离子有_____(任写两种)。
②CO32-中碳原子的杂化轨道类型为___________________________。
③分解产物中属于非极性分子的是____________________(填选项字母)。
a.NH3 b. CO2 C.N2 d. H2O
(4)UO2的晶胞结构及晶胞参数如图所示:
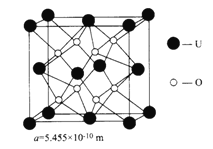
①晶胞中U 的配位数为__________________________。
②UO2晶体的密度为_____________g·cm-3(列出计算式即可。设NA表示阿伏加德罗常数的值)。
【答案】 1s22s22p63s23p64s2(或[Ar]4s2) CaO和MgO均为离子晶体,MgO的晶格能大于CaO 68% abcd 正四面体 CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4 sp2 bc 8 (4×270)/[NA×(5.455×10-8)3]
【解析】(1) CaO和MgO都是由活泼金属与活泼非金属组成的化合物,属于离子化合物,离子晶体的熔点由其晶格能大小决定,MgO的晶格能大于CaO,故熔点:MgO(2852℃)高于CaO(2614℃);钙为20号元素,基态钙原子的核外电子排布式为1s22s22p63s23p64s2或[Ar]4s2;金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为68%;(2)NH4HF2中NH4+与HF2-间为离子键,H-N为极性共价键、配位键;HF2-的结构式为[F-H![]() F]-含有氢键结构。答案选abcd;(3)①NH4+中的N为sp3杂化,四个N—H键的键能、键长及键角均相同,空间构型为正四面体;等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或原子团,与NH4+互为等电子体的分子或离子有CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4;②CO32-价层电子对数目为
F]-含有氢键结构。答案选abcd;(3)①NH4+中的N为sp3杂化,四个N—H键的键能、键长及键角均相同,空间构型为正四面体;等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或原子团,与NH4+互为等电子体的分子或离子有CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4;②CO32-价层电子对数目为![]() =3,碳原子的杂化轨道类型为sp2杂化;③a、NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子,故a错误;b、CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故b正确;c、H2O中含有极性键,为V形分子,但结构不对称,属于极性分子,故c错误;d、H2O中含有极性键,为V形分子,但结构不对称,属于极性分子,故d错误;答案选bc;(4)①由晶胞的面心观察,可知U的配位数为8,O的配位数为4;②晶胞中U为
=3,碳原子的杂化轨道类型为sp2杂化;③a、NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子,故a错误;b、CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故b正确;c、H2O中含有极性键,为V形分子,但结构不对称,属于极性分子,故c错误;d、H2O中含有极性键,为V形分子,但结构不对称,属于极性分子,故d错误;答案选bc;(4)①由晶胞的面心观察,可知U的配位数为8,O的配位数为4;②晶胞中U为![]() ,O为8,立方体体积为
,O为8,立方体体积为![]() ,
,  。
。


科目:高中化学 来源: 题型:
【题目】碳的氧化物对环境的影响较大,CO是燃煤工业生产中的大气污染物,CO2则促进了地球的温室效应。给地球生命带来了极大的威胁。
(1)已知:①甲醇的燃烧热△H=-726.4kJ·mol-1
②H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8kJ·mol-1。
O2(g)=H2O(l) △H=-285.8kJ·mol-1。
则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为_____________________________。
(2)二氧化碳合成CH3OH 的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
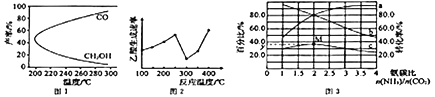
(3)以某些过渡金属氧化物作催化剂,二氧化碳与甲烷可转化为乙酸:CO2(g) +CH4(g)![]() CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
(4)一定条件下,CO2 与NH3 可合成尿素[CO(NH2)2]:CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比
CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比![]() 的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
A. 新平衡体系中,SO2和O2物质的量之比仍为2∶1
B. 平衡向正反应方向移动,原因是正反应速率增大,逆反应速率减小
C. 新平衡体系与旧平衡体系比较,SO3的浓度肯定增大
D. 若采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8gNaOH固体溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为__mol/L;若取出10mL该溶液,则Na+的物质的量浓度为__mol/L,其中含NaOH的质量为____g;将这500 mL溶液浓缩成100mL后,NaOH的物质的量浓度为__mol/L,若所得溶液的密度为dg/mL,则该浓溶液溶质的质量分数为____________(蒸发过程中没有溶质析出)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验事实,不能得到相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向醋酸溶液中滴加少量Na2SiO3溶液,观察到白色沉淀 | 醋酸的酸性强于H2SiO3 |
B | 向均盛有2mL5% H2O2溶液的两支试管中分别滴入0.2mol/LFeCl3和0.3mol/LCuCl2溶液各1mL,前者生成气泡的速率更快 | 催化效果: Fe3+> Cu2+ |
C | 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢 | 反应产生气泡速度变化,是因为醋酸电离平衡先正向移动,再逆向移动 |
D | 常温下分别测等浓度的醋酸和氨水pH,二者的pH 分别为2和12 | 常温下,醋酸和氨水的电离平衡常数相等 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰干电池在放电时,电池的总反应方程式可以表示为: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。电池放电时,负极上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
试题分析:根据总反应方程式可知Zn在反应中失去电子,发生氧化反应,所以作原电池的负极,MnO2得到电子,发生还原反应,作原电池的正极。因此答案是选项A。
考点:考查根据原电池反应原理确定电池的电极材料的知识
【题型】单选题
【结束】
17
【题目】在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)![]() 2NH3(g) H=-92.2 kJ·mol-1 ,据此回答以下问题:
2NH3(g) H=-92.2 kJ·mol-1 ,据此回答以下问题:
(1)①某温度下,若把 10 mol N2 与 30 mol H2置于体积为 10 L 的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为 20%,则该温度下反应的K=_______ (可用分数表示)。
②对于合成氨反应而言,下列有关图像一定正确的是______(选填序号)。
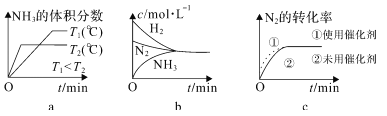
③在碱性溶液中通过电解法可以实现由 N2 制取 NH3:2N2+6H2O![]() 4NH3+3O2,阴极的电极反应式是_______________。
4NH3+3O2,阴极的电极反应式是_______________。
(2)室温下,若将 0.1 mol·L-1 盐酸滴入 20 mL 0.1 mol·L-1 氨水中,溶液 pH 随加入盐酸体积的变化曲线如下图所示。
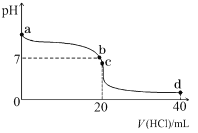
①NH3·H2O 的电离方程式是_______________。
②b 点所示溶液中的溶质是_______________。
③c 点所示溶液中,离子浓度从大到小的关系为_______________。
④常温下,若将 amol/LNH3·H2O 与等体积的 bmol/L 的盐酸混合,充分反应后溶液呈中性(不考虑氨水和盐酸的挥发),则该温度下 NH3·H2O 的电离常数Ka=___________(用含 a 和 b 的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com