
【题目】分子式为C4H9Cl的同分异构体(含对映异构)有( )
A. 2种 B. 3种 C. 4种 D. 5种
科目:高中化学 来源: 题型:
【题目】有四种短周期元素,它们的结构、性质等信息如表所述:
元素 | 结构、性质等信息 |
X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质与冷水剧烈反应 |
Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒剂和杀菌剂 |
请根据表中信息填写:
(1)X元素在周期表中的位置________;其相对分子质量最小的气态氢化物常用作______。
(2)工业上制取Y单质常用的方法是(用化学方程式表示)_________。
(3)Y离子半径比Z离子的半径________(填“大”或“小”)。
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于________(填“吸热”或“放热”)反应,写出反应的化学方程式为______________。
(5)举出实例说明M的非金属性比X强:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请填写下列空白:
(1)步骤③和⑤的实验操作名称分别是________________、____________。
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是________,该装置的操作名称为__________。
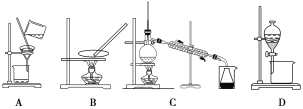
(3)步骤④反应的离子方程式是___________________________。
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能导电是 , 属于电解质是 , 属于非电解质的是 . (填序号,多选或错选扣分)
①水银 ②烧碱 ③硫酸钡 ④氯化钠晶体 ⑤盐酸 ⑥蔗糖.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查阅教材得知,普通锌锰电池筒内无机物的主要成分为MnO2、NH4C1、ZnCl2等。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验。下列有关实验的叙述不正确的是
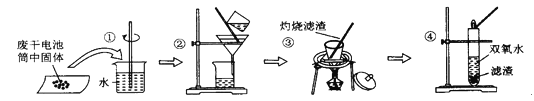
A. 操作①中玻璃棒能加快固体溶解
B. 操作②为过滤,得到的滤液显酸性
C. 操作③盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol (NH4)2S的质量为__g。
(2)标准状况下,1.7 g NH3与__LH2S气体含有的氢原子数相同。
(3)标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量为__mol,RO2的相对分子质量为__。
(4)与0.2molH2含有相同电子数目的氦气分子的物质的量为_____。
(5)标准状况下, NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为____,该气体对氢气的相对密度为___,NH3的体积分数为____。
(6)同温同压下,等体积的CO和CO2的物质的量之比__,所含氧元素的质量比__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质](15 分)
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3等。
回答下列问题:
(1) UF4用Mg或Ca 还原可得金属铀。基态钙原子的核外电子排布式为__________________;熔点:MgO(2852℃)高于CaO(2614℃),原因是_______________________________;金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为_______________________________。
(2)已知:2UO2+5NH4HF2 ![]() 2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
a.氢键 b.配位键 c.共价键 d.离子键 e.金属键
(3)已知:3[(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
①NH4+的空间构型为_____________________,与NH4+互为等电子体的分子或离子有_____(任写两种)。
②CO32-中碳原子的杂化轨道类型为___________________________。
③分解产物中属于非极性分子的是____________________(填选项字母)。
a.NH3 b. CO2 C.N2 d. H2O
(4)UO2的晶胞结构及晶胞参数如图所示:
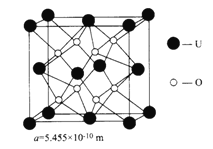
①晶胞中U 的配位数为__________________________。
②UO2晶体的密度为_____________g·cm-3(列出计算式即可。设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.链节是高分子化合物中重复出现的结构单元,如聚乙烯的链节是CH2=CH2
B.丙烯和聚丙烯都能使溴水褪色
C.高分子化合物没有固定的熔沸点
D.加聚反应生存环境高分子化合物的同时,还有H2O等小分子物质生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
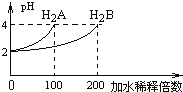
A. H2A为二元弱酸,稀释前c(H2A)=0.005mol/L
B. NaHA水溶液中:c(Na+)+ c(H+)= 2c(A2-)+ c(OH-)
C. 含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2-)+ c(B2-)+ c(HB-)+ c(H2B)
D. pH=10的NaHB溶液中,离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com