
【题目】某同学查阅教材得知,普通锌锰电池筒内无机物的主要成分为MnO2、NH4C1、ZnCl2等。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验。下列有关实验的叙述不正确的是
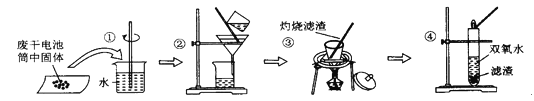
A. 操作①中玻璃棒能加快固体溶解
B. 操作②为过滤,得到的滤液显酸性
C. 操作③盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中的杂质
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氧化石墨烯具有优良的生物亲和性和亲水性,可通过下列实验方法制得(装置如图所示):
①低温阶段:控温0℃,烧瓶中加入3g石墨烯、12 g KMnO4和100 mL浓硫酸,搅拌反应20 min;
②中温阶段:水浴控温15℃,反应2 h;再控湿35℃,反应40 min;
③高温阶段:用220 mL高纯水稀释反应液,控温80℃,反应20 min,再滴入10 mL 30%H2O2溶液,控温45℃,待胶体变为金黄色,静置24 h;倾出上层清液,用盐酸洗涤下层沉淀,过滤、高纯水洗涤、真空干燥,得到氧化石墨烯。
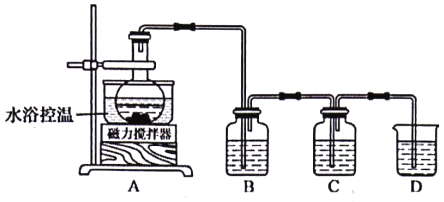
回答下列问题:
(1)将石墨中的层状结构剥离就能得到石墨烯,石墨烯的化学成分是_______(写名称)。
(2)“低温阶段”控温0℃的方法是____________。
(3)装置B装入酸性KMnO4溶液,其目的是_________;装置C用于检测CO2的生成,则判断有CO2生成的实验现象是_______________。
(4)“高温阶段”中,控温80℃之前,必须加入高纯水稀释反应液,稀释的操作方法是_______。“高温阶段”若温度过高,反应液极易发生“暴沸”而导致实验失败,其原因是__________。
(5)“高温阶段”滴入10 mL 30% H2O2溶液的目的是为了除去过量的KMnO4,反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的混合气体X和铜跟浓硝酸反应产生的混合气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )

A. 洗气瓶中产生的沉淀是BaCO3
B. 在Z导管出来的气体中无CO2
C. 洗气瓶中产生的沉淀是BaSO3
D. 在Z导管口有红棕色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
A. 新平衡体系中,SO2和O2物质的量之比仍为2∶1
B. 平衡向正反应方向移动,原因是正反应速率增大,逆反应速率减小
C. 新平衡体系与旧平衡体系比较,SO3的浓度肯定增大
D. 若采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯(a)、苯乙烯(b)\、立方烷(c)的分子式均为C8H8,下列说法正确的是
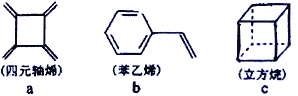
A. a 的同分异构体只有b 和c两种
B. a、b、c均能使溴的四氯化碳溶液褪色
C. a、b分子中的所有原子一定处于同一平面
D. a、c的二氯代物有3种,b的一氯代物有5 种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8gNaOH固体溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为__mol/L;若取出10mL该溶液,则Na+的物质的量浓度为__mol/L,其中含NaOH的质量为____g;将这500 mL溶液浓缩成100mL后,NaOH的物质的量浓度为__mol/L,若所得溶液的密度为dg/mL,则该浓溶液溶质的质量分数为____________(蒸发过程中没有溶质析出)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验事实,不能得到相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向醋酸溶液中滴加少量Na2SiO3溶液,观察到白色沉淀 | 醋酸的酸性强于H2SiO3 |
B | 向均盛有2mL5% H2O2溶液的两支试管中分别滴入0.2mol/LFeCl3和0.3mol/LCuCl2溶液各1mL,前者生成气泡的速率更快 | 催化效果: Fe3+> Cu2+ |
C | 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢 | 反应产生气泡速度变化,是因为醋酸电离平衡先正向移动,再逆向移动 |
D | 常温下分别测等浓度的醋酸和氨水pH,二者的pH 分别为2和12 | 常温下,醋酸和氨水的电离平衡常数相等 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
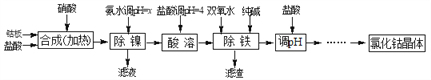
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______时,除镍效果最好。
加NH3·H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________。
(4)“除铁”步骤中加入的纯碱作用是________________________________。
(5)在“调pH”步骤中,加盐酸的作用是______________________________。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为_____________________。
Fe(OH)3+3H+的平衡常数为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com