
【题目】将8gNaOH固体溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为__mol/L;若取出10mL该溶液,则Na+的物质的量浓度为__mol/L,其中含NaOH的质量为____g;将这500 mL溶液浓缩成100mL后,NaOH的物质的量浓度为__mol/L,若所得溶液的密度为dg/mL,则该浓溶液溶质的质量分数为____________(蒸发过程中没有溶质析出)。
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 若2.24L某气体中含有的分子数为0.1NA,则该气体所处的状态一定为标准状况
B. 一定条件下,密闭容器中1.4gN2与0.2molH2充分反应,转移的电子数为0.3NA
C. 0.1mol熔融状态下的NaHSO4中含有的阴离子数为0.2NA
D. 7.4g丁醇中存在的共价键总数为1.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A. 此时刻正反应速率大于逆反应速率
B. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
C. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
D. a=1.64
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查阅教材得知,普通锌锰电池筒内无机物的主要成分为MnO2、NH4C1、ZnCl2等。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验。下列有关实验的叙述不正确的是
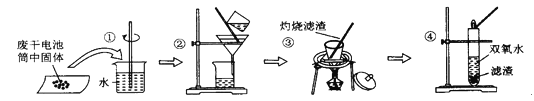
A. 操作①中玻璃棒能加快固体溶解
B. 操作②为过滤,得到的滤液显酸性
C. 操作③盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A到F是化合物,且A、B、E、F均含钠元素,G是单质.

(1)写出A、B、E、F的化学式:A________,B________,E________,F________.
(2)写出反应①②③的化学方程式:① _____________________________② _________________________________③__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质](15 分)
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3等。
回答下列问题:
(1) UF4用Mg或Ca 还原可得金属铀。基态钙原子的核外电子排布式为__________________;熔点:MgO(2852℃)高于CaO(2614℃),原因是_______________________________;金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为_______________________________。
(2)已知:2UO2+5NH4HF2 ![]() 2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
a.氢键 b.配位键 c.共价键 d.离子键 e.金属键
(3)已知:3[(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
①NH4+的空间构型为_____________________,与NH4+互为等电子体的分子或离子有_____(任写两种)。
②CO32-中碳原子的杂化轨道类型为___________________________。
③分解产物中属于非极性分子的是____________________(填选项字母)。
a.NH3 b. CO2 C.N2 d. H2O
(4)UO2的晶胞结构及晶胞参数如图所示:
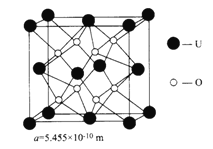
①晶胞中U 的配位数为__________________________。
②UO2晶体的密度为_____________g·cm-3(列出计算式即可。设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是 ( )
A. 纯碱溶于热水后去污效果增强,说明纯碱的水解反应是吸热反应
B. NH3(g) + HCl(g) = NH4Cl(s) 在较低温度下能自发进行,说明该反应的ΔH>0
C. 500℃、30 MPa下,将7 g N2和3 g H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的燃烧热(ΔH)为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
【答案】A
【解析】A. 纯碱溶于热水后去污效果增强,说明升高温度促进了水解,使水解平衡正向移动,所以可以说明纯碱的水解是吸热反应,故A正确;B. 根据△G=△H-T△S可知,当△G小于0时反应自发进行,由于反应NH3(g) + HCl(g) = NH4Cl(s)是熵值减小的反应,所以如果该反应在较低温度下能自发进行,则说明该反应的△H<0,故B错误;C.因合成氨的反应是可逆反应,所以无法确定将7 g N2和3 g H2置于密闭容器中充分反应后,生成了多少NH3(g),故无法计算该反应的焓变,故C错误;D. 燃烧热指的是1mol纯物质完全燃烧生成稳定的氧化物时所放出的能量,所以生成的水应为液态,即甲烷燃烧的热化学方程式应表示为CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,故D错误;答案选A。
【题型】单选题
【结束】
14
【题目】在0.1 mol·L-1的CH3COOH溶液中,要抑制醋酸电离,且c(H+)增大,应采取的措施是
A. 加水 B. 升温 C. 加适量CH3COONa固体 D. 通适量HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如下图实验可检验某食品中亚硫酸盐含量(所加试剂均足量)。下列说法不正确的是

A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com