
【题目】氮的单质及一些化合物在工农业生产等领域有重要应用,回答下列问题
(1)羟胺 ( 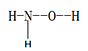 ) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
①羟胺分子中采用sp3杂化的原子是____________________;羟胺极易溶于水,主要原因是________________________________。
②在羟胺的组成的元素中,处于同一周期元素的第四电离能(I4)较大的是______________(用元素符号表示)。
(2) 吡啶![]() 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有![]() 键的物质的量为_________ mol。
键的物质的量为_________ mol。
(3)已知:每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
①NO2 + CO ![]() CO2 + NO
CO2 + NO
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
【答案】N、O 羟胺分子与水分子可形成分子间氢键,故羟胺易溶于水 N 11 2NO(g)+2 CO (g)![]() N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol
N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol
【解析】
(1)①羟胺分子中,价层电子对为4的原子有N、O原子,所以采用sp3杂化的原子有N、O原子,羟胺分子与水分子可形成分子间氢键,故羟胺易溶于水。
②在羟胺的组成的元素中,处于同一周期元素是N和O,N原子失去3个电子后价电子排布式为2s2,O原子失去3个电子后价电子排布式为2s22p1。
(2)根据吡啶![]() 的结构简式可知,每个吡啶分子含有11个σ键。
的结构简式可知,每个吡啶分子含有11个σ键。
(3)根据盖斯定律计算。
(1)①羟胺分子中,价层电子对为4的原子有N、O原子,所以采用sp3杂化的原子有N、O原子,羟胺分子与水分子可形成分子间氢键,故羟胺易溶于水,故答案为:N、O ;羟胺分子与水分子可形成分子间氢键,故羟胺易溶于水。
②在羟胺的组成的元素中,处于同一周期元素是N和O,N原子失去3个电子后价电子排布式为2s2,2s处于全充满状态,较稳定,O原子失去3个电子后价电子排布式为2s22p1,故第四电离能(I4)较大的是N,故答案为:N。
(2)根据吡啶![]() 的结构简式可知,每个吡啶分子含有11个σ键,故l mol吡啶中含有
的结构简式可知,每个吡啶分子含有11个σ键,故l mol吡啶中含有![]() 键的物质的量为11 mol,故答案为:11。
键的物质的量为11 mol,故答案为:11。
(3)NO与CO反应生成无污染物气体为CO2和N2,反应的方程式为2NO+2CO![]() N2+2CO2,
N2+2CO2,
根据表中数据可知,反应①NO2(g) + CO (g) ![]() CO2(g) + NO (g)的ΔH=(812+1076)kJ/mol-(1490+632)kJ/mol=-234 kJ/mol,已知②N2(g)+O2(g)
CO2(g) + NO (g)的ΔH=(812+1076)kJ/mol-(1490+632)kJ/mol=-234 kJ/mol,已知②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol ,③2NO(g) +O2(g)
2NO(g) ΔH=+179.5 kJ/mol ,③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol 根据盖斯定律可知,①×2+ ③-②得2NO(g)+2 CO (g)
2NO2(g) ΔH=-112.3 kJ/mol 根据盖斯定律可知,①×2+ ③-②得2NO(g)+2 CO (g)![]() N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol,故答案为:2NO(g)+2CO (g)
N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol,故答案为:2NO(g)+2CO (g)![]() N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol。
N2(g) +2CO2 (g)ΔH=-759.8 kJ/mol。


科目:高中化学 来源: 题型:
【题目】立方烷(C8H8)、棱晶烷(C6H6)是近年来运用有机合成的方法制备的,具有如下图所示立体结构的环状有机物。萜类化合物是广泛存在于动植物体内的一类有机物(例如盆烯、月桂烯、柠檬烯等)。
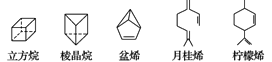
对上述有机物的下列说法中正确的是( )
①盆烯、月桂烯、柠檬烯都能使溴水褪色
②棱晶烷、盆烯与苯互为同分异构体
③月桂烯、柠檬烯互为同分异构体
④立方烷、棱晶烷是环烷烃的同系物
A. ①②③ B. ①②④ C. ①③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途。请回答下列问题。
![]() 基态硫离子价层电子的轨道表达式为____,其电子填充的最高能级的轨道数为____。
基态硫离子价层电子的轨道表达式为____,其电子填充的最高能级的轨道数为____。
![]() 常见含硫的物质有单质硫
常见含硫的物质有单质硫![]() 、
、![]() 、
、![]() 、
、![]() 等,四种物质的熔点由高到低的顺序依次为__________。
等,四种物质的熔点由高到低的顺序依次为__________。
![]() 方铅矿
方铅矿![]() 即硫化铅
即硫化铅![]() 是一种比较常见的矿物,酸溶反应为:
是一种比较常见的矿物,酸溶反应为:![]() 浓
浓![]() ,则
,则![]() 中配位原子是__________,第一电离能
中配位原子是__________,第一电离能![]() __________
__________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,
,![]() 中硫的杂化方式为______________,下列气态分子的空间构型与
中硫的杂化方式为______________,下列气态分子的空间构型与![]() 相同的有__________。
相同的有__________。
A.SnCl2 B.SO3 ![]()
![]()
![]() 方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的__________空隙中。已知晶体密度为ρg·cm-3,阿伏加德罗常数的值为
方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的__________空隙中。已知晶体密度为ρg·cm-3,阿伏加德罗常数的值为![]() ,则晶胞中硫离子与铅离子最近的距离为__________nm。
,则晶胞中硫离子与铅离子最近的距离为__________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下反应中的四种物质由三种元素组成,其中a的分子空间构型为正四面体形,一个a分子含有10e-,组成b物质的元素为第3周期元素。下列判断正确的是
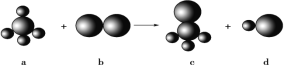
A. 四种分子中的化学键均是极性键B. a、c分子中中心原子均采用sp3杂化
C. 四种分子中既有σ键,又有π键D. b、d分子中共价键的键能:b>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | ⑩ |
请回答下列问题:
(1)表中⑨号属于______ 区元素。
(2)表中元素③的2个原子与元素①的2个原子形成的某种直线型分子名称为 ________ ; ③和⑧形成的一种常见溶剂,其分子立体空间构型为________ 。
(3)元素①和⑥形成的最简单分子X属于 ________ 分子(填“极性”或“非极性”)。
(4)元素⑥的第一电离能 ________ 元素⑦的第一电离能;元素②的电负性________ 元素④的电负性(选填“>”、“=”或“<”)。
(5)元素⑨的基态原子核外价电子排布式是 ________ 。
(6)元素⑧和④形成的化合物的电子式为 ________ 。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素⑩与元素⑤的氢氧化物有相似的性质。请写出元素⑩的氢氧化物与NaOH溶液反应的化学方程式:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO![]() 、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。25 ℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。下列说法错误的是
、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。25 ℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。下列说法错误的是

A. 25 ℃时,HClO2的电离平衡常数的数值Ka=10-6
B. 使用该漂白剂的最佳pH为3.0
C. 25 ℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO![]() )+2c(OH-)
)+2c(OH-)
D. 该温度下的NaClO2溶液中c(Na+)>c(ClO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列各组物质制备和收集气体,能采用如图装置的是

A.浓氨水与生石灰反应制NH3
B.浓盐酸与二氧化锰反应制Cl2
C.过氧化氢溶液与二氧化锰反应制O2
D.FeS与稀硫酸反应制H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等体积混合而成的4组气体.①NO2+NO、②NO2+O2、③HCl+N2、④Cl2+SO2.现将其分别通入体积相同的试管中并立即倒立在足量水中,试管内水面上升的高度分别为h1、h2、h3、h4,则高度关系是
A.h4>h2>h3>h1 B.h4>h3>h2>h1
C.h2>h3>h1>h4 D.h3>h2>h1>h4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式为:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
(1)反应物HCl中氯元素的化合价为___。
(2)在该氧化还原反应中,MnO2做___剂,锰元素被___,而HCl在反应中表现的性质包括___和___。
(3)若有6molCl2生成时,反应中转移___mol电子。
(4)写出该反应的离子方程式___,用双线桥法标出电子转移的方向和数目:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com