
【题目】已知以下反应中的四种物质由三种元素组成,其中a的分子空间构型为正四面体形,一个a分子含有10e-,组成b物质的元素为第3周期元素。下列判断正确的是
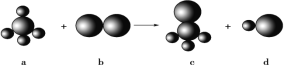
A. 四种分子中的化学键均是极性键B. a、c分子中中心原子均采用sp3杂化
C. 四种分子中既有σ键,又有π键D. b、d分子中共价键的键能:b>d
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -116 |
回答下列问题:
(1)写出该实验过程中发生的所有主要反应的化学方程式____;
在此制各实验中,要尽可能迅速地把反应温度170℃左右,其最主要目的是___(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入__,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层,若产物中有少量未反应的Br2,最好用____洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(4)若产物中有少量副产物乙醚。可用____的方法除去,加热方式为____。
(5)反应过程中应用___冷却装置D
A.冰水混合物 B.室温下的水 C.60℃ D.100℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确是( )
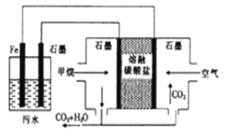
A. 铁电极的电极反应式为Fe-2e-=Fe2+
B. 通入甲烷的石墨的电极反应式为:CH4+4CO32-—8e- ==5CO2+2H2O
C. 为了增强的污水的导电能力,可向污水中加入适量食盐
D. 若左池石墨电极产生44.8L气体,则消耗0.5mol甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是

A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. YM3、WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 键角:BF3>CH4>H2O>NH3
B. CO2、HClO、HCHO分子中一定既有σ键又有π 键
C. 已知反应N2O4(l)+2N2H4(l) = 3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为1.5NA
D. 在硅酸盐中,SiO44-四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图,其中Si原子的杂化方式与图中S8单质中S原子的杂化方式相同


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及一些化合物在工农业生产等领域有重要应用,回答下列问题
(1)羟胺 ( 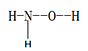 ) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
①羟胺分子中采用sp3杂化的原子是____________________;羟胺极易溶于水,主要原因是________________________________。
②在羟胺的组成的元素中,处于同一周期元素的第四电离能(I4)较大的是______________(用元素符号表示)。
(2) 吡啶![]() 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有![]() 键的物质的量为_________ mol。
键的物质的量为_________ mol。
(3)已知:每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
①NO2 + CO ![]() CO2 + NO
CO2 + NO
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰干电池在放电时,电池的总反应方程式可以表示为: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。电池放电时,负极上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
试题分析:根据总反应方程式可知Zn在反应中失去电子,发生氧化反应,所以作原电池的负极,MnO2得到电子,发生还原反应,作原电池的正极。因此答案是选项A。
考点:考查根据原电池反应原理确定电池的电极材料的知识
【题型】单选题
【结束】
17
【题目】在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1000mL硝酸钾和硝酸铜的混合溶液中c(NO3-)=3.0mol/L,用石墨做电极电解此溶液,当通电一段时间后两极均收集到22.4L气体(标准状况)。下列说法正确的是( )
A. 原混合溶液中钾离子浓度为2mol/LB. 上述电解过程中共转移6mol电子
C. 电解得到的铜的物质的量为0.5molD. 电解后溶液中氢离子浓度为2mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com