
【题目】电浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确是( )
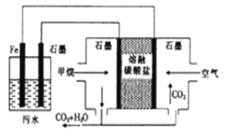
A. 铁电极的电极反应式为Fe-2e-=Fe2+
B. 通入甲烷的石墨的电极反应式为:CH4+4CO32-—8e- ==5CO2+2H2O
C. 为了增强的污水的导电能力,可向污水中加入适量食盐
D. 若左池石墨电极产生44.8L气体,则消耗0.5mol甲烷
【答案】D
【解析】
在甲烷燃料电池中,通入甲烷的一极为原电池的负极,发生氧化反应,电极方程式为CH4+4CO32-—8e- =5CO2+2H2O,通入空气(氧气)的一极为原电池的正极,发生还原反应,电极方程式为O2+2CO2 +4e-=2CO32- ,铁连接原电池的正极,为电解池的阳极,被氧化,电极方程式为Fe-2e-=Fe2+ ,阴极电极方程式为2H + + 2e - =H2↑。
A.铁连接原电池的正极,为电解池的阳极,被氧化,电极反应为Fe-2e-=Fe2+ ,故不选A;
B.通甲烷的一极为原电池的负极,发生氧化反应,电极方程式为CH4+4CO32-—8e- =5CO2+2H2O,故不选B;
C.加入的使导电能力增强的电解质必须是可溶于水的、不参与电极反应的盐,可用食盐,故不选C;
D.未说明标准状况,无法计算,故选D;
答案:D


科目:高中化学 来源: 题型:
【题目】在AgC1悬浊液中存在平衡: AgCl (s)![]() Ag+(aq)+Cl-(aq)。已知常温下,Ksp (AgCl)=1.6×10-10 (mol/L)2。下列叙述正确的是
Ag+(aq)+Cl-(aq)。已知常温下,Ksp (AgCl)=1.6×10-10 (mol/L)2。下列叙述正确的是
A. 常温下,AgCl 悬浊液中c (C1-)= 4×10-5.5mol/L
B. 温度不变时,向AgCl 悬浊液中加入少量NaCl 粉末,平衡向左移动,Ksp减小
C. 向AgCl悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl) sp(AgBr)
D. 常温下,将0.001 mol·L-1AgNO3溶液与0.001 mol·L-1的KCl 溶液等体积混合,无沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(C8H8)、棱晶烷(C6H6)是近年来运用有机合成的方法制备的,具有如下图所示立体结构的环状有机物。萜类化合物是广泛存在于动植物体内的一类有机物(例如盆烯、月桂烯、柠檬烯等)。
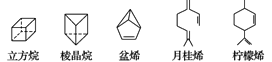
对上述有机物的下列说法中正确的是( )
①盆烯、月桂烯、柠檬烯都能使溴水褪色
②棱晶烷、盆烯与苯互为同分异构体
③月桂烯、柠檬烯互为同分异构体
④立方烷、棱晶烷是环烷烃的同系物
A. ①②③ B. ①②④ C. ①③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序。请你原电池原理和实验装置,完成下列实验报告。
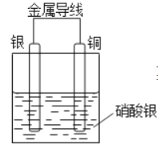
实验目的:探究Cu和Ag的金属活动性顺序
(1)电极材料:正极:_______________________ ;负极:_____________________________硝酸银溶液的作用是________________________________________________________
(2)写出电极反应式:
正极:_____________________________ ;负极:_____________________________ 。
(3)实验现象:________________________________________________________________。
(4)实验结论:________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中主要污染物为SO2、NO、NO2,可用如图工艺进行脱硫脱硝及产物回收。
(1)空气预处理过程中,发生主要反应的化学方程式为_______。
(2)洗气过程中,尿素作还原剂,转化成两种无污染的气体的化学式是_______
(3)充分曝气氧化过程中,发生反应的含镁化合物是_________。
(4)完成沉镁过程中生成碱式碳酸镁的离子方程式___Mg2++____= MgCO3Mg(OH)2↓+__CO2↑+____H2O
(5)(NH4)2SO4粗品中含有的主要杂质为_________(填名称)。
(6)碱式碳酸镁经过简单加工可循环利用,加工过程发生反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,CO(g) + H2O (g)![]() CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
甲 | 乙 | |||
起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
下列判断不正确的是
A.x = y = 0.16
B.反应开始时,乙中反应速率比甲快
C.甲中0~5min的平均反应速率: v(CO)=0.004"mol/(L·min)
D.平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途。请回答下列问题。
![]() 基态硫离子价层电子的轨道表达式为____,其电子填充的最高能级的轨道数为____。
基态硫离子价层电子的轨道表达式为____,其电子填充的最高能级的轨道数为____。
![]() 常见含硫的物质有单质硫
常见含硫的物质有单质硫![]() 、
、![]() 、
、![]() 、
、![]() 等,四种物质的熔点由高到低的顺序依次为__________。
等,四种物质的熔点由高到低的顺序依次为__________。
![]() 方铅矿
方铅矿![]() 即硫化铅
即硫化铅![]() 是一种比较常见的矿物,酸溶反应为:
是一种比较常见的矿物,酸溶反应为:![]() 浓
浓![]() ,则
,则![]() 中配位原子是__________,第一电离能
中配位原子是__________,第一电离能![]() __________
__________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,
,![]() 中硫的杂化方式为______________,下列气态分子的空间构型与
中硫的杂化方式为______________,下列气态分子的空间构型与![]() 相同的有__________。
相同的有__________。
A.SnCl2 B.SO3 ![]()
![]()
![]() 方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的__________空隙中。已知晶体密度为ρg·cm-3,阿伏加德罗常数的值为
方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的__________空隙中。已知晶体密度为ρg·cm-3,阿伏加德罗常数的值为![]() ,则晶胞中硫离子与铅离子最近的距离为__________nm。
,则晶胞中硫离子与铅离子最近的距离为__________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下反应中的四种物质由三种元素组成,其中a的分子空间构型为正四面体形,一个a分子含有10e-,组成b物质的元素为第3周期元素。下列判断正确的是
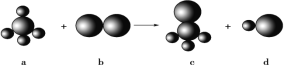
A. 四种分子中的化学键均是极性键B. a、c分子中中心原子均采用sp3杂化
C. 四种分子中既有σ键,又有π键D. b、d分子中共价键的键能:b>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等体积混合而成的4组气体.①NO2+NO、②NO2+O2、③HCl+N2、④Cl2+SO2.现将其分别通入体积相同的试管中并立即倒立在足量水中,试管内水面上升的高度分别为h1、h2、h3、h4,则高度关系是
A.h4>h2>h3>h1 B.h4>h3>h2>h1
C.h2>h3>h1>h4 D.h3>h2>h1>h4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com