
【题目】在AgC1悬浊液中存在平衡: AgCl (s)![]() Ag+(aq)+Cl-(aq)。已知常温下,Ksp (AgCl)=1.6×10-10 (mol/L)2。下列叙述正确的是
Ag+(aq)+Cl-(aq)。已知常温下,Ksp (AgCl)=1.6×10-10 (mol/L)2。下列叙述正确的是
A. 常温下,AgCl 悬浊液中c (C1-)= 4×10-5.5mol/L
B. 温度不变时,向AgCl 悬浊液中加入少量NaCl 粉末,平衡向左移动,Ksp减小
C. 向AgCl悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl) sp(AgBr)
D. 常温下,将0.001 mol·L-1AgNO3溶液与0.001 mol·L-1的KCl 溶液等体积混合,无沉淀析出
【答案】A
【解析】A. 常温下,AgCl悬浊液中c(C1-)= c(Ag+)=![]() =
=![]() =4×10-5.5mol/L,故A正确;B. 温度不变时,向AgCl悬浊液中加入少量NaCl粉末,c(C1-)增大,抑制氯化银的溶解,但温度不变,Ksp不变,故B错误;C. 向AgCl悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)>Ksp(AgBr),故C错误;D. 常温下,将0.001 mol·L-1AgNO3溶液与0.001 mol·L-1的KCl溶液等体积混合,Qc= c(C1-)×c(Ag+)=1×10-6>Ksp(AgCl)=1.6×10-10,有沉淀析出,故D错误;故选A。
=4×10-5.5mol/L,故A正确;B. 温度不变时,向AgCl悬浊液中加入少量NaCl粉末,c(C1-)增大,抑制氯化银的溶解,但温度不变,Ksp不变,故B错误;C. 向AgCl悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)>Ksp(AgBr),故C错误;D. 常温下,将0.001 mol·L-1AgNO3溶液与0.001 mol·L-1的KCl溶液等体积混合,Qc= c(C1-)×c(Ag+)=1×10-6>Ksp(AgCl)=1.6×10-10,有沉淀析出,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 增加气体反应物浓度,单位体积内活化分子数增加,活化分子百分数增加,有效碰撞次数增加,所以反应速率加快
B. 镁与稀盐酸反应时,加入适量的氯化钾溶液,生成氢气的速率不变
C. 对于可逆反应,升高反应体系温度,正反应速率和逆反应速率均增加
D. 在密闭容器中发生反应 A(g)+B(g)![]() C(g)+D(g),保持恒温恒容,充入气体 He 增大压强,化学反应速率加快
C(g)+D(g),保持恒温恒容,充入气体 He 增大压强,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从石油中裂解获得 A 是目前工业上生产A的主要途径,图中的 N 是高分子化合物。以 A 和 1,3 一丁二烯为原料合成 N 的流程如下:

(1)D 物质的名称为_____;B→C 的化学反应方程式为_____________。
(2)G 中含氧官能团的名称为_____________,由 G→H 的反应类型为_________。
(3)在催化剂存在下,E 和 M 等物质的量发生聚合反应,N 的结构简式为__________。
(4)E 有多种同分异构体,符合下列条件的同分异构体最多有______种。
①可与 Na2CO3 溶液反应;②分子中只有一个环状结构。
(5)天然橡胶是异戊二烯的聚合物,其单体是 CH2=C(CH3)CH=CH2。试以异戊二烯为原料(其他无机试剂任选),设计制备 的合成路线,请写出合成路线流程图_____。
的合成路线,请写出合成路线流程图_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为_____________。
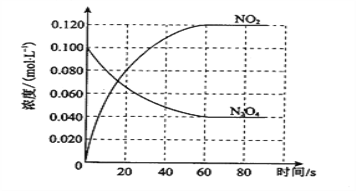
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。T______100 ℃(填“大于”或“小于”),判断理由是____________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定化学用语正确的是( )
A. NaHCO3水解的离子方程式:HCO3-+H2O = CO32-+H3O+
B. Ba(OH)2的电离方程式:Ba(OH)2![]() Ba2++2OH-
Ba2++2OH-
C. NaHSO4在水中的电离方程式:NaHSO4= Na++H++SO42-
D. Na2S水解的离子方程式:S2-+2H2O = H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O = 2Mg (OH)2 。下列关于该电池的说法错误的是( )

A. 食盐水作为电解质溶液
B. 电池工作时镁片作为正极逐渐被消耗
C. 电池工作时实现了化学能向电能的转化
D. 活性炭电极上的反应为O2+2H2O + 4e- = 4OH -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,固定容器中,无论以何比例混合,其密度都不变的是
A. CH4 和 C2H4 B. C3H6和 CO2
C. C2H6和 C2H4 D. CO和C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。
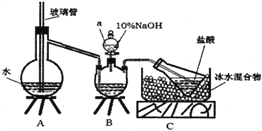
步骤二,氯的测定:准确称取橙黄色晶体wg,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)上述装置A中,玻璃管的作用是________;装置B中仪器a的名称为_________。
(2)装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在____(填“A”或“B”)处。
(3)步骤一所称取的样品中含氮的质量为_________g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将_______(填“偏高”、“偏低”或“无影响”);冰水混合物的作用是___________。
(5)测定氯的过程中,使用棕色滴定管的原因是_________;出现浅红色沉淀时,若溶液中c(CrO42-)=0.0025mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因______(呈现计算过程)。已知:Ksp(Ag2CrO4)=1.0×10-12Ksp(AgCl)=1.8×10-10
(6)经上述实验测定,配合物M中钴、氮、氯的物质的量之比为1:6:3,其中氮元素以氨的形式存在。制备M的化学方程式为_____________________,其中双氧水的作用是__________;制备M的过程中温度不能过高的原因是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com