
【题目】维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。
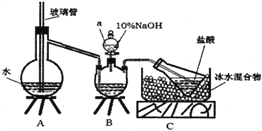
步骤二,氯的测定:准确称取橙黄色晶体wg,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)上述装置A中,玻璃管的作用是________;装置B中仪器a的名称为_________。
(2)装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在____(填“A”或“B”)处。
(3)步骤一所称取的样品中含氮的质量为_________g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将_______(填“偏高”、“偏低”或“无影响”);冰水混合物的作用是___________。
(5)测定氯的过程中,使用棕色滴定管的原因是_________;出现浅红色沉淀时,若溶液中c(CrO42-)=0.0025mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因______(呈现计算过程)。已知:Ksp(Ag2CrO4)=1.0×10-12Ksp(AgCl)=1.8×10-10
(6)经上述实验测定,配合物M中钴、氮、氯的物质的量之比为1:6:3,其中氮元素以氨的形式存在。制备M的化学方程式为_____________________,其中双氧水的作用是__________;制备M的过程中温度不能过高的原因是_________________。
【答案】 平衡气压(当A中压力过大时,安全管中液面上升,使A瓶中压力稳定) 分液漏斗 A 42.00 偏高 减少盐酸的挥发,有利于氨气的吸收 AgNO3见光易分解 当溶液中出现Ag2CrO4沉淀时,c2(Ag+)×c(CrO42-)=1.0×10-12,代入求得c (Ag+)=2.0×10-5 mol/L。此时c (Ag+)×c(Cl-)=1.8×10-10,代入求得 c(Cl-)=9.0×10-6 mol/L<1.0×10-5 mol/L,所以当出现浅红色沉淀时Cl-已完全沉淀。 2CoCl2+2NH4Cl+10NH3+H2O2![]() 2[Co(NH3)6]Cl3+2H2O 氧化剂 温度过高过氧化氢分解、氨气逸出
2[Co(NH3)6]Cl3+2H2O 氧化剂 温度过高过氧化氢分解、氨气逸出
【解析】试题分析:本题考查物质组成的探究实验。涉及中和滴定的计算和误差分析,溶度积的计算,化学方程式的书写和反应条件的控制。
(1)装置A中玻璃管的作用是平衡气压,当A中压力过大时,安全管中液面上升,使A瓶中压力稳定。装置B中仪器a的名称为分液漏斗。
(2)依据题中的实验步骤,在晶体中加入NaOH溶液充分反应后,通入水蒸气将氨全部蒸出,所以酒精灯应放置在A处,产生水蒸气。
(3)25.00mL吸收液中过量的n(HCl)=n(NaOH)=2mol/L![]() 0.0125L=0.025mol,则吸收氨气的n(HCl)=7mol/L
0.0125L=0.025mol,则吸收氨气的n(HCl)=7mol/L![]() 0.5L-0.025mol
0.5L-0.025mol![]() =3mol,根据反应NH3+HCl=NH4Cl,n(NH3)=3mol,根据N守恒,样品中m(N)=3mol
=3mol,根据反应NH3+HCl=NH4Cl,n(NH3)=3mol,根据N守恒,样品中m(N)=3mol![]() 14g/mol=42.00g。
14g/mol=42.00g。
(4)由于盐酸的挥发,吸收NH3的HCl偏大,会造成测得氮的含量结果将偏高。冰水混合物的作用是:减少盐酸的挥发,有利于氨气的吸收。
(5)氯的测定中以AgNO3标准溶液进行滴定,由于AgNO3溶液见光易分解,所以用棕色滴定管。当溶液中出现Ag2CrO4沉淀时,c2(Ag+)![]() c(CrO42-)=1.0×10-12,将c(CrO42-)=0.0025mol/L代入求得c(Ag+)=2.0×10-5 mol/L。此时c(Ag+)×c(Cl-)=1.8×10-10,代入求得c(Cl-)=9.0×10-6 mol/L<1.0×10-5 mol/L,所以当出现浅红色沉淀时Cl-已完全沉淀。
c(CrO42-)=1.0×10-12,将c(CrO42-)=0.0025mol/L代入求得c(Ag+)=2.0×10-5 mol/L。此时c(Ag+)×c(Cl-)=1.8×10-10,代入求得c(Cl-)=9.0×10-6 mol/L<1.0×10-5 mol/L,所以当出现浅红色沉淀时Cl-已完全沉淀。
(6)配合物M中钴、氮、氯的物质的量之比为1:6:3,其中氮元素以氨的形式存在,M的化学式为[Co(NH3)6]Cl3。配合物M以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成,在反应中Co元素的化合价由+2价升至+3价,H2O2作为氧化剂被还原成H2O,根据得失电子守恒和原子守恒,制备M的化学方程式为:2CoCl2+2NH4Cl+10NH3+H2O2![]() 2[Co(NH3)6]Cl3+2H2O。在反应中双氧水作氧化剂。由于双氧水受热易分解,氨水受热分解逸出氨气,所以制备M的过程中温度不能过高。
2[Co(NH3)6]Cl3+2H2O。在反应中双氧水作氧化剂。由于双氧水受热易分解,氨水受热分解逸出氨气,所以制备M的过程中温度不能过高。


科目:高中化学 来源: 题型:
【题目】在AgC1悬浊液中存在平衡: AgCl (s)![]() Ag+(aq)+Cl-(aq)。已知常温下,Ksp (AgCl)=1.6×10-10 (mol/L)2。下列叙述正确的是
Ag+(aq)+Cl-(aq)。已知常温下,Ksp (AgCl)=1.6×10-10 (mol/L)2。下列叙述正确的是
A. 常温下,AgCl 悬浊液中c (C1-)= 4×10-5.5mol/L
B. 温度不变时,向AgCl 悬浊液中加入少量NaCl 粉末,平衡向左移动,Ksp减小
C. 向AgCl悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl) sp(AgBr)
D. 常温下,将0.001 mol·L-1AgNO3溶液与0.001 mol·L-1的KCl 溶液等体积混合,无沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组研究采用BMED 膜堆(示意图如右),模拟精制浓海水为原料直接制备酸碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、D)。已知: 在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH-。下列说法错误的是( )
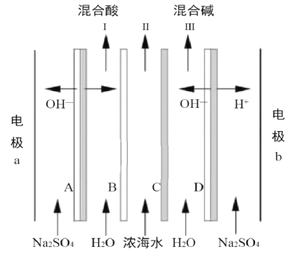
A. 电极a连接电源的正极 B. B为阳离子交换膜
C. 电解质溶液采用Na2SO4溶液可避免有害气体的产生 D. Ⅱ排出的是淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是一种广谱杀菌消毒剂,有众多的用途,工业上制取二氧化氯的化学方程式如下:2NaClO3+ 2NaCl+2H2SO4![]() 2ClO2↑+Cl2↑+2H2O+2Na2SO4。
2ClO2↑+Cl2↑+2H2O+2Na2SO4。
(1)完成下列计算:0.2 mol NaClO3完全反应,得到气体的体积为__________L(标准状况)。
(2)将27.0 g ClO2溶于水得0.5 L溶液,则ClO2的物质的量浓度为__________mol/L。
(3)为使上述反应产生的Cl2转化为ClO2,将得到的混合气体和NaClO2反应,反应方程式为:2NaClO2 + Cl2![]() 2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)_____。
2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对生产有重大的指导意义。回答下列问题:
(1)有两个温度相同的密闭容器A和B,容器A保持容积不变,容器B保持压强不变,起始时向容积相等的A、B中分别充入等量的C(碳)和H2O(g),发生反应:C(s)+H2O(g)![]() CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
①H2O的体积分数:V(A)%_____V(B)%。(填“>”、“<” “=”)
②达到平衡后,在两容器中分别通入等量的氦气,则A中H2O的转化率_______(填“增大” “减小”、“不变”);B中化学平衡_________移动(填“不”“向正反应方向”“向逆反应方向”)。
(2)某温度下,测得0.01mol·L-1 NaOH溶液的pH=10,则在该温度下Kw=______;在此温度下,将pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得溶液为中性,则a:b=_______(假设混合时体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】示踪原子法是研究化学反应的重要方法之一,下列化学方程式正确的是
A. 2Na2O2+2H218O= 4NaOH+18O2 ↑
B. 2KMnO4+5H218O +3H2SO4= K2SO4+2MnSO4+ 518O2↑+8H2O
C. CH3C18OOH + CH3OH![]() CH3CO18OCH3+H2O
CH3CO18OCH3+H2O
D. 6H37Cl+ NaClO3==NaCl+37Cl2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关纯羊毛线的叙述,正确的是( )
A. 组成纯羊毛线的基本单位是核苷酸
B. 纯羊毛线形成过程中一定有水产生
C. 纯羊毛服装可以用加入蛋白酶的洗衣粉清洗
D. 纯羊毛线中一定含有的化学元素是C、H、O、N、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据反应8NH3+3Cl2![]() 6NH4Cl+N2,回答下列问题:
6NH4Cl+N2,回答下列问题:
①该反应中氧化剂是______________,氧化产物是___________________。
②该反应中被氧化的物质与被还原的物质物质的量之比为________________。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是__________,还原剂是___________。
②该反应中1 mol氧化剂____________(填“得到”或“失去”)____________mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是__________L。
④请把各物质填在下面空格处,需配平:
□______+□______=□______+□______+□______+□
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大。A与B、C分别构成电子数相等的化合物W、K,且W是一种能产生温室效应的气体;D元素最外层电子数是次外层电子数的3倍。A、D、E构成化合物Y,A、B、C、D构成化合物X,且X、Y均为阳离子和阴离子个数比是1∶1的离子化合物。回答下列问题:
(1)推断元素D为___________。
(2)Y的电子式为_______;物质W为_______,其晶体中存在的作用力有_______。
(3)与E同主族且为第7周期的元素原子序数为________。
(4)A与C形成的K是生产某种常用肥料的重要原料,写出其被催化氧化的反应方程式______。
(5)X、Y按1∶2反应的离子方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com