
【题目】从石油中裂解获得 A 是目前工业上生产A的主要途径,图中的 N 是高分子化合物。以 A 和 1,3 一丁二烯为原料合成 N 的流程如下:

(1)D 物质的名称为_____;B→C 的化学反应方程式为_____________。
(2)G 中含氧官能团的名称为_____________,由 G→H 的反应类型为_________。
(3)在催化剂存在下,E 和 M 等物质的量发生聚合反应,N 的结构简式为__________。
(4)E 有多种同分异构体,符合下列条件的同分异构体最多有______种。
①可与 Na2CO3 溶液反应;②分子中只有一个环状结构。
(5)天然橡胶是异戊二烯的聚合物,其单体是 CH2=C(CH3)CH=CH2。试以异戊二烯为原料(其他无机试剂任选),设计制备 的合成路线,请写出合成路线流程图_____。
的合成路线,请写出合成路线流程图_____。
【答案】 苯甲醇 CH2Br-CH2Br+2NaOH![]() CH2OH-CH2OH+2NaBr 羟基 加成反应
CH2OH-CH2OH+2NaBr 羟基 加成反应 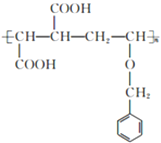 或
或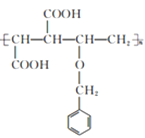 19
19 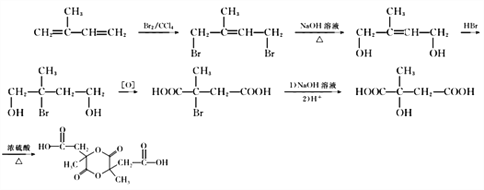
【解析】
因为A来自于石油的裂解,所以可以猜测A是某种烯烃。那么根据各步的反应条件可以推测,![]() 的反应为加成,
的反应为加成,![]() 为卤代烃水解得到醇,C和D的反应是醇分子间脱水得到醚(
为卤代烃水解得到醇,C和D的反应是醇分子间脱水得到醚(![]() ),所以C、D一定是乙二醇和苯甲醇(
),所以C、D一定是乙二醇和苯甲醇(![]() )中的一个,所以可以推出A为乙烯,a可能为
)中的一个,所以可以推出A为乙烯,a可能为![]() 的
的![]() 溶液,B为
溶液,B为![]() ,C为乙二醇,D为苯甲醇(
,C为乙二醇,D为苯甲醇(![]() )。
)。![]() 在浓硫酸加热条件下发生脱水消去得到E(
在浓硫酸加热条件下发生脱水消去得到E(![]() )。考虑到1,3-丁二烯经过几步反应得到
)。考虑到1,3-丁二烯经过几步反应得到![]() ,即1,4位是相同官能团,所以生成F的反应一定是1,4-加成,即F为
,即1,4位是相同官能团,所以生成F的反应一定是1,4-加成,即F为![]() 。F水解得到得到的G为
。F水解得到得到的G为![]() 。G和
。G和![]() 加成得到的H为
加成得到的H为![]() ,H氧化为
,H氧化为![]() ,
,![]() 在氢氧化钠醇溶液加热的条件下发生消去反应,再酸化得到M(
在氢氧化钠醇溶液加热的条件下发生消去反应,再酸化得到M(![]() ),最后E和M共聚得到
),最后E和M共聚得到 或
或。
(1)根据上述分析D(![]() )物质的名称为苯甲醇;
)物质的名称为苯甲醇;![]() 的化学反应方程式为
的化学反应方程式为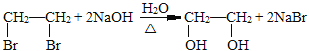 。
。
(2)G(![]() )中官能团的名称为:羟基;
)中官能团的名称为:羟基;
由 G→H 的反应类型为:加成反应;
(3)E和M共聚得到 或
或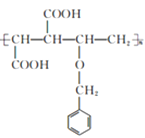 。
。
(4)E为![]() ,分子式为
,分子式为![]() ,不饱和度为5。同分异构体要求①可与
,不饱和度为5。同分异构体要求①可与![]() 溶液反应,所以分子只能含有一个酚羟基(只有一个氧原子,无法得到羧基);②分子中只有一个环状结构,就是苯环,苯环有4个不饱和度,则另外的一个不饱和度只能是一个碳碳双键。由上述信息,同分异构体可能为
溶液反应,所以分子只能含有一个酚羟基(只有一个氧原子,无法得到羧基);②分子中只有一个环状结构,就是苯环,苯环有4个不饱和度,则另外的一个不饱和度只能是一个碳碳双键。由上述信息,同分异构体可能为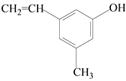 (三个不同的取代基在苯环上进行排列应该得到10种同分异构体),或者
(三个不同的取代基在苯环上进行排列应该得到10种同分异构体),或者![]() (有邻间对三种同分异构)或者
(有邻间对三种同分异构)或者![]() (有邻间对三种同分异构)或者
(有邻间对三种同分异构)或者![]() (有邻间对三种同分异构),所以同分异构体总计为19种。
(有邻间对三种同分异构),所以同分异构体总计为19种。
(5)将 按照如图形式拆分
按照如图形式拆分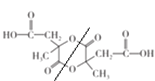 得到
得到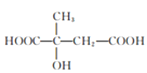 所以只要用异戊二烯得到
所以只要用异戊二烯得到 就可以酯化为最终产物。由异戊二烯得到
就可以酯化为最终产物。由异戊二烯得到 的过程可以参考框图为
的过程可以参考框图为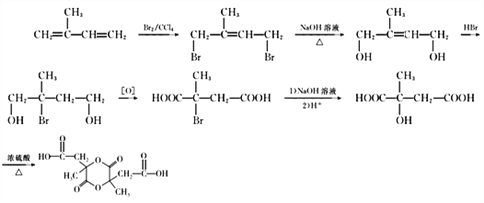 。
。
故本题正确答案合成路线为: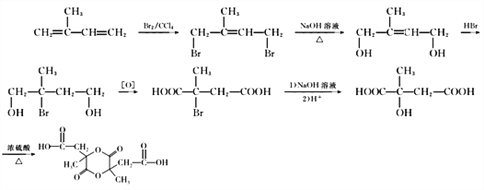 。
。


科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | M | R | Q | U | |
原子半径( | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | 0.82 | |
主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | +3 | |
最低负价 | -1 | -3 | -2 | |||||
下列说法错误的是( )
A. 元素X和Q形成的化合物中不可能含有共价键
B. X、Z、R的最高价氧化物的水化物之间可两两相互反应
C. R3-比Q2-更容易失去电子
D. M(OH)2的碱性比XOH的碱性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的离子方程式正确的是
A. 实验室制取Cl2时,用NaOH溶液吸收尾气:Cl2 + 2OH- =ClO-+ Cl-+H2O
B. 向FeCl3溶液中加入Fe粉,溶液变为浅绿色:Fe3+ + Fe =2Fe2+
C. 铜片放入稀HNO3中生成气体:Cu + 4H+ +2NO![]() =Cu2+ + 2NO2↑+2H2O
=Cu2+ + 2NO2↑+2H2O
D. Ba(OH)2溶液与稀H2SO4反应生成白色沉淀:Ba2+ + SO42- + H+ +OH- =BaSO4↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80℃时,2 L密闭容器中充入0.40 mol N2O4,发生如下反应:N2O4(g)![]() 2NO2(g)。一段时间后达到平衡,测得数据如下:
2NO2(g)。一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/( mol·L1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
请回答:
(1)20 s内,v(NO2) =_________mol/(L·s) 1。
(2)升高温度时,c(NO2)增大,则正反应是______(选填“放热”或“吸热”)反应。
(3)该温度下反应的化学平衡常数数值为______。
(4)该条件下N2O4的平衡转化率是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分,将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
[提出猜想]
猜想1:该气体为CO2。
猜想2:该气体为SO2。
猜想3:______________________________________________________。
为了验证猜测,该小组设计实验加以探究。
[实验探究]
该小组同学按如图所示装置,将气体从a端通入。
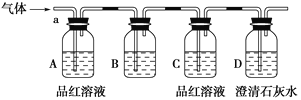
(1)B中应该装下列________试剂(填编号)。
A.NaCl溶液 B.酸性KMnO4溶液 C.盐酸 D.澄清石灰水
(2)A中品红溶液的作用是________________________________________________。
(3)D中澄清石灰水的作用是______________________________________________。通过该实验,该小组同学观察到以下三个实验现象:①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
[得出结论]
(4)由上述现象,该小组同学确认该气体的成分为:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Br-、Cl-、CrO42- B. Cl-、Br-、CrO42-
C. CrO42-、Br-、Cl- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AgC1悬浊液中存在平衡: AgCl (s)![]() Ag+(aq)+Cl-(aq)。已知常温下,Ksp (AgCl)=1.6×10-10 (mol/L)2。下列叙述正确的是
Ag+(aq)+Cl-(aq)。已知常温下,Ksp (AgCl)=1.6×10-10 (mol/L)2。下列叙述正确的是
A. 常温下,AgCl 悬浊液中c (C1-)= 4×10-5.5mol/L
B. 温度不变时,向AgCl 悬浊液中加入少量NaCl 粉末,平衡向左移动,Ksp减小
C. 向AgCl悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl) sp(AgBr)
D. 常温下,将0.001 mol·L-1AgNO3溶液与0.001 mol·L-1的KCl 溶液等体积混合,无沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组研究采用BMED 膜堆(示意图如右),模拟精制浓海水为原料直接制备酸碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、D)。已知: 在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH-。下列说法错误的是( )
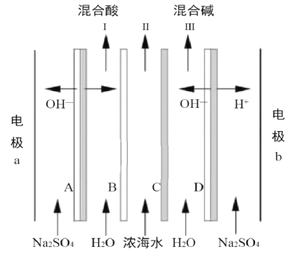
A. 电极a连接电源的正极 B. B为阳离子交换膜
C. 电解质溶液采用Na2SO4溶液可避免有害气体的产生 D. Ⅱ排出的是淡水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com