
【题目】1000mL硝酸钾和硝酸铜的混合溶液中c(NO3-)=3.0mol/L,用石墨做电极电解此溶液,当通电一段时间后两极均收集到22.4L气体(标准状况)。下列说法正确的是( )
A. 原混合溶液中钾离子浓度为2mol/LB. 上述电解过程中共转移6mol电子
C. 电解得到的铜的物质的量为0.5molD. 电解后溶液中氢离子浓度为2mol/L
【答案】D
【解析】
石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),阴极发生反应为:Cu2++2e-=Cu、2H++2e-=H2↑,阳极发生反应为:4OH--4e-=O2↑+2H2O,n(O2)= 22.4L÷22.4L/mol=1mol,结合电子守恒及物质的量浓度的计算来解答。
石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=22.4L÷22.4L/mol=1mol,阳极发生电极反应为:4OH--4e-=O2↑+2H2O,阴极发生的电极反应为:Cu2++2e-=Cu、2H++2e-=H2↑。
A.根据同一闭合回路中电子转移数目相等,结合阴极上离子的放电顺序可知,溶液中Cu2+的浓度为:c(Cu2+)=![]() =1mol/L,由电荷守恒可知,原混合溶液中c(K+)为3mol/L-1mol/L×2=1mol/L,A错误;
=1mol/L,由电荷守恒可知,原混合溶液中c(K+)为3mol/L-1mol/L×2=1mol/L,A错误;
B.根据氧气来计算反应过程中转移电子的物质的量,n(e-)=1mol×4=4mol,B错误;
C.电解得到的Cu的物质的量为1mol,C错误;
D.电解后溶液中c(H+)为:c(H+)=![]() =2mol/L,D正确;
=2mol/L,D正确;
故合理选项是D。


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】已知以下反应中的四种物质由三种元素组成,其中a的分子空间构型为正四面体形,一个a分子含有10e-,组成b物质的元素为第3周期元素。下列判断正确的是
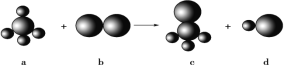
A. 四种分子中的化学键均是极性键B. a、c分子中中心原子均采用sp3杂化
C. 四种分子中既有σ键,又有π键D. b、d分子中共价键的键能:b>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等体积混合而成的4组气体.①NO2+NO、②NO2+O2、③HCl+N2、④Cl2+SO2.现将其分别通入体积相同的试管中并立即倒立在足量水中,试管内水面上升的高度分别为h1、h2、h3、h4,则高度关系是
A.h4>h2>h3>h1 B.h4>h3>h2>h1
C.h2>h3>h1>h4 D.h3>h2>h1>h4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图所示。请填写下列空白:

(1)在该溶液中含有的离子是_____________,物质的量浓度之比为_______________。
(2)所加的淡黄色固体是________________(化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol/L盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。已知:
①加入固体A的质量m≤3.2 g时,收集到的气体为H2;
②当m>3.2 g时,收集到的气体为H2和H2S的混合气体。
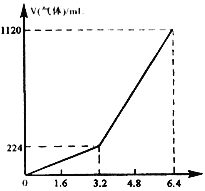
⑴3.2 g固体A中所含的物质有______________。
⑵3.2 g固体A中各物质的物质的量分别为______________,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为______________(忽略溶液体积的变化)。
⑶当固体A全部溶于上述盐酸,且A的质量m>3.2 g时,收集到的气体体积(标准状况下)V=______________mL(用含m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备气体和验证气体性质的装置图。
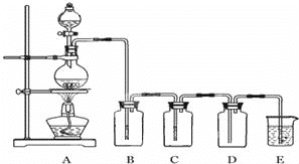
若利用如图装置实现碳和浓硫酸的反应,并进行如下验证:
①装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则D装置中品红溶液的作用是______,证明气体中有CO2的现象是______。
②若证明SO2具有氧化性,同时证明碳酸的酸性比硅酸的强,B、C、D中分别装有Na2S溶液、足量酸性KMnO4溶液、品红溶液。
则:B中的现象______,E中应加入______溶液,E中发生反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式为:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
(1)反应物HCl中氯元素的化合价为___。
(2)在该氧化还原反应中,MnO2做___剂,锰元素被___,而HCl在反应中表现的性质包括___和___。
(3)若有6molCl2生成时,反应中转移___mol电子。
(4)写出该反应的离子方程式___,用双线桥法标出电子转移的方向和数目:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8gCH4共有___mol氢原子,0.1molNH3共有约___个原子,同温同压下,同体积的NH3和H2S气体的质量比为___;同温同压下,同质量的NH3和H2S气体的体积比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学。掌握实验方法以及完成化学实验所需要的技能,是学好化学的关键。
(1)正确使用仪器、按正确的步骤进行实验都是实验成功的关键。请回答:
①分液时,分液漏斗中的液体很难滴下,原因是:_____________________________。
②容量瓶使用之前,必须进行的操作为:___________________________。
③可燃性气体与空气混合点燃可能会爆炸,所以可燃性气体点燃前应先________________。
(2)欲测定某铝铜合金的组成,进行了如下实验:称取粉末状样品1.0克,加入某浓度的盐酸10 mL ,充分反应后,收集到标准状况下气体224 mL ;然后,再往样品中加入同浓度的盐酸10 mL ,充分反应后又收集到标准状况下气体112 mL 。求:
①所取盐酸的物质的量浓度为________________。
②样品中铝的质量分数为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com