
����Ŀ��X��Y��Z��M��WΪ���ֶ�����Ԫ�ء�Xԭ�ӵ�����������Ӳ�����ͬ��Wԭ�Ӻ����������Mԭ��������������2����Y��Z��M��W�����ڱ��е����λ����ͼ��ʾ������˵������ȷ����

A. ԭ�Ӱ뾶��W>Y>Z>M>X
B. ���ȶ��ԣ�XM>X2Z���е㣺X2Z>YX3
C. X��Y��Z����Ԫ���γɵĻ������в����ܺ����Ӽ�
D. YM3��WM4������ÿ��ԭ������������8���ӽṹ
���𰸡�C
��������Xԭ�ӵ�����������Ӳ�����ͬ����XΪH��Wԭ�Ӻ����������Mԭ��������������2����WΪSi��YΪN��ZΪO��MΪF�����Ӳ���Խ�࣬ԭ�Ӱ뾶Խ��ͬ����Ԫ�أ������ң�ԭ�Ӱ뾶��С����ԭ�Ӱ뾶��Si>N>O>F>H��A��ȷ���ǽ����ԣ�F>O�����ȶ��ԣ�HF>H2O�����³�ѹ�£�ˮ��Һ�壬��NH3�����壬�е㣺H2O>NH3��B��ȷ�� H��N��O���γ�NH4NO3�����ͻ�����������Ӽ���C���� NF3��SiF4������ÿ��ԭ������������8���ӽṹ��D��ȷ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2��g��+O2��g��=2SO3��g����Ӧ���̵������仯��ͼ��ʾ��
��֪1mol SO2��g������Ϊ1mol SO3��g���ġ�H=��99kJmol��1 �� ��ش��������⣺
��1��ͼ��A��C�ֱ��ʾ��
��2��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ������Ӱ�죿 �� �÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B�������ǽ��ͣ� �� ������
��3��ͼ�С�H=KJmol��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q��X��Y��ZΪ������Ԫ�أ����������ڱ��е�λ����ͼ��ʾ����4��Ԫ�ص�ԭ������������֮��Ϊ22������˵����ȷ����
![]()
A. Y��ԭ�Ӱ뾶��X�Ĵ�
B. Q������������ˮ��������Ա�Z��ǿ
C. X��Y����3��Ԫ���γɵĻ������ж�ֻ�й��ۼ�
D. Q�ĵ��ʾ��а뵼������ʣ�Q��Z���γɻ�����QZ4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A+B3C+4D�У���ʾ�÷�Ӧ���������ǣ�������
A.�ԣ�A��=0.5molL��1S��1
B.�ԣ�B��=0.3 molL��1S��1
C.�ԣ�C��=0.8molL��1S��1
D.�ԣ�D��=1 molL��1S��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п����ΪʳƷпǿ������ԭ�ϡ���ҵ�ϳ�����п����������п����п�����Ҫ�ɷ���ZnCO3����������Fe2O3 ��FeCO3 ��MgO��CaO�ȣ�������������ͼ���£�
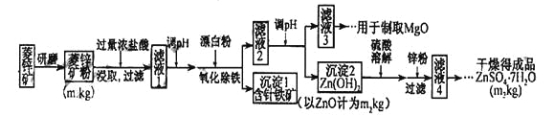
��1������п����ĥ�ɷ۵�Ŀ����___________________��
��2����������������������з�Ӧ�����ӷ���ʽ��
��Fe(OH)2+ ��____+ ��_____="=" ��Fe(OH)3+ ��Cl_
��3��������Goethite�����Ե¹�ʫ�˸�£�Goethe�����������ģ����Ԫ����Fe��O��H ����ѧʽʽ��Ϊ89����ѧʽ��_______ ��
��4�������±����ݣ���������Һ2����pHʱ�������Ͽ�ѡ�õ��������Ϊ______ ��
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
��ʼ������pH | 10��4 | 6��4 | �� | �� |
������ȫ��pH | 12��4 | 8��0 | �� | �� |
��ʼ�ܽ��pH | �� | 10��5 | �� | �� |
Ksp | 5��6��10-12 | �� | 6��8��10-6 | 2��8��10-9 |
��5����ҵ�ϴ�����Һ3����ȡMgO�����У����ʵķ�Ӧ����_________��ѡ����ţ���
a������ʯ�� b��ʯ���� c��������Һ d���ռ���Һ
��6������Һ4��֮��IJ�������Ϊ ______ ��_______ �����ˣ�ϴ�ӣ����
��7������ͼ�����ݣ���п�����ZnC3���������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MOH��ROH����һԪ�����Һ�ֱ��ˮϡ��ʱ��pH�仯��ͼ��ʾ�����������в���ȷ���ǣ�������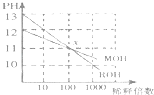
A.ROH��һ��ǿ��
B.��x�㣬MOH��û����ȫ����
C.��x�㣬c��M+��=c��R+��
D.ϡ��ǰ��c��ROH��=10c��MOH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���в���ֱ�Ӳ��ʯī���������ɼ��鷴Ӧ�ķ�Ӧ�ȣ����ɲ�����飬ʯī������ȼ�յķ�Ӧ�ȣ�CH4��g��+2O2��g���TCO2��g��+2H2O��l����H1=��890.3kJ/mol
C��ʯī��+O2��g���TCO2��g����H2=��393.5kJ/mol
H2��g��+ ![]() O2��g���TH2O��l����H3=��285.8kJ/mol������ʯī���ɼ���ķ�Ӧ�ȣ�
O2��g���TH2O��l����H3=��285.8kJ/mol������ʯī���ɼ���ķ�Ӧ�ȣ�
C��ʯī��+2H2��g���TCH4��g����H4= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ʵ�֡���ȫ���¶�����������2�����ڡ�����ѧ�������о���������CH4��CO2��ת�������á�
��1������˵����ȷ����__________(�����)��
A. CH4��CO2���Ӿ�Ϊ���м��Թ��ۼ��ķǼ��Է��� B. ��һ�����ܣ�O>N>C
C. �е�ߵͣ�CH4>SnH4>GeH4>SiH4 D. CH![]() ���ӵĿռ乹��Ϊƽ����������
���ӵĿռ乹��Ϊƽ����������
��2��CH4��CO2��Ni�������·�Ӧ�ɻ�û���ԭ��CO��H2��
��Ni��̬ԭ�Ӻ�������Ų�ʽΪ__________��
����CO��Ϊ�ȵ�����������ӵĵ���ʽΪ__________��Ni����CO�γ����������ε������Ni(CO)4��1 mol Ni(CO)4�к��ЦҼ�����ĿΪ__________��
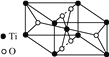
��3��CH4��CO2�ں������������ij�ִ�������������ֱ��ת��ΪCH3COOH��
��CH3COOH��Cԭ�ӹ���ӻ�����Ϊ__________��
���������ᄃ���ṹ��ͼ��ʾ��д���仯ѧʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ���������������Ԫ�صĴ��ڵIJ�����
A.����������ֱ�Ӽ���AgNO3��Һ
B.������ˮ����ֽ������AgNO3��Һ
C.����NaOH��Һ�����Ⱥ����ϡ�����ữ��Ȼ�����AgNO3��Һ
D.����NaOH���Ҵ���Һ�����Ⱥ����AgNO3��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com