
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程图如下:
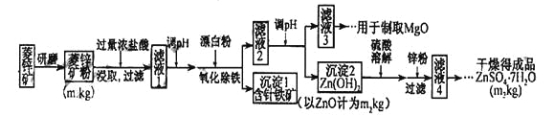
(1)将菱锌矿研磨成粉的目的是___________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+ □____+ □_____="=" □Fe(OH)3+ □Cl_
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H ,化学式式量为89,化学式是_______ 。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______ 。
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
Ksp | 5.6×10-12 | — | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是_________(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为 ______ 、_______ 、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnC3的质量分数不低于 。
【答案】(1) 增大接触面积,加快反应速率,使反应更充分
(2)2Fe(OH)2+ 1 ClO+ 1H2O ="=" 2Fe(OH)3+ 1Cl_
((3)FeO(OH) (4) 8.0≤pH<10.4 (5) bd
(6) 蒸发浓缩 、 冷却结晶 (7) (125m2/81m1)×100%
【解析】试题分析:(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加充分。
(2)流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO-,观察方程式前后可以推出还要加入水分子,据原子守恒配平得:2Fe(OH)2+ 1 ClO+ 1H2O ="=" 2Fe(OH)3+ 1Cl_。
(3)化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH)。
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH,pH应介于8.0≤pH<10.4。
(5)从“滤液3”制取MgO过程中,应先生成Mg(OH)2,溶液碱性应较强,bd符合,而纯碱溶液水解呈碱性,碱性较弱。
(6)“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发、结晶、过滤后洗涤并干燥。
(7)设碳酸锌的质量为m,利用关系式法计算:ZnCO3----ZnO
125 81
m m2
ZnCO3的质量为125m2/81,ZnCO3的质量分数为 125m2/81m1。


科目:高中化学 来源: 题型:
【题目】实验室制Cl2的反应为4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O.下列说法错误的( )
MnCl2+Cl2↑+2H2O.下列说法错误的( )
A.还原剂是HCl,氧化剂是MnO2
B.每消耗1 mol HCl,转移电子的物质的量为2 mol
C.每生成1 mol Cl2 , 转移电子的物质的量为2 mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意进行填空:
(1)对于下列反应:2SO2+O22SO3 , 如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 , 用O2浓度变化来表示的反应速率为 . 如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(Lmin),那么2min时SO2的浓度为 .
(2)图1表示在密闭容器中反应:2SO2+O22SO3△H=﹣198kJ/mol达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是;b c过程中改变的条件可能是; 若增大压强时,反应速度变化情况画在c~d处.
(3)将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)2HI(g);△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图2曲线(Ⅱ)所示:
若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示.则甲条件可能是 , 则乙条件可能是 .
(填入下列条件的序号)
①恒容条件下,升高温度;
②恒容条件下,降低温度;
③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;
⑤恒温恒容条件下,加入适当催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是食用碘盐包装上的部分说明,下列说法正确的是( )
配料 | 精盐、碘酸钾、抗结剂 |
碘含量 | 35±15mgkg﹣1 |
储存方法 | 密封、避光、防潮 |
食用方法 | 烹饪时,待食品熟后加入碘盐 |
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.可用淀粉检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50 mgkg﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.溶液能透过半透膜,而胶体和浊液均不能
B.胶体和其它分散系的本质区别是分散质粒子的大小
C.硫酸钡几乎不溶于水,所以它是非电解质
D.CO2溶于水能导电,但是它却是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是

A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. YM3、WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2升的密闭容器内加入0.2mol的N2和0.6mol 的H2 , 在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度的变化的情况如右图:
(1)根据下图,计算从反应开始到平衡时,平均反应速率v(NH3)为 . 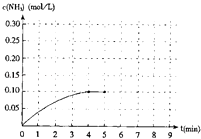
(2)该反应的化学平衡常数表达式为 .
(3)反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 .
A、0.20mol/L B、0.16mol/L C、0.10mol/L D、0.05mol/L
(4)反应达到平衡后,第5分钟时,保持其它条件不变,若只把容器的体积缩小一半,平衡移动(填“向左”、“向右”或“不”),化学平衡常数K填“增大”、“减小”或“不变”).
(5)第5分钟把容器的体积缩小一半后,若在第8分钟达到新的平衡(此时NH3的浓度约为0.25mol/L),请在上图中画出第5分钟到此平衡时NH3浓度的变化曲线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气燃烧生成水蒸气的能量变化如图所示。下列说法正确的是

A. 燃烧时化学能全部转化为热能
B. 断开1mol氧氢键吸收930kJ能量
C. 相同条件下,1mol氢原子的能量为E1,1mol氢分子的能量为E2,则2E1<E2
D. 该反应生成1mol水蒸气时能量变化为245kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com