
【题目】根据题意进行填空:
(1)对于下列反应:2SO2+O22SO3 , 如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为 , 用O2浓度变化来表示的反应速率为 . 如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(Lmin),那么2min时SO2的浓度为 .
(2)图1表示在密闭容器中反应:2SO2+O22SO3△H=﹣198kJ/mol达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是;b c过程中改变的条件可能是; 若增大压强时,反应速度变化情况画在c~d处.
(3)将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)2HI(g);△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图2曲线(Ⅱ)所示:
若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示.则甲条件可能是 , 则乙条件可能是 .
(填入下列条件的序号)
①恒容条件下,升高温度;
②恒容条件下,降低温度;
③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;
⑤恒温恒容条件下,加入适当催化剂.
【答案】
(1)2mol/(L?min),1mol/(L?min),2mol/L
(2)升温,减小SO3浓度
(3)③⑤,④
【解析】解:(1)对于下列反应:2SO2+O22SO3△H<0,如果2min内SO2的浓度由6mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为v= ![]() =
= ![]() mol/(Lmin)=2mol/(Lmin),用O2浓度变化来表示的反应速率=
mol/(Lmin)=2mol/(Lmin),用O2浓度变化来表示的反应速率= ![]() ×2mol/(Lmin)=1mol/(Lmin),
×2mol/(Lmin)=1mol/(Lmin),
如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(Lmin),氧气消耗浓度=0.5mol/(Lmin)×2min=1mol/L,化学方程式定量计算得到消耗二氧化硫浓度为2mol/L,则二氧化硫的平衡浓度=4mol/L﹣1mol/L=2mol/L,
所以答案是:2mol/(Lmin);2mol/(Lmin);2mol/L;
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为
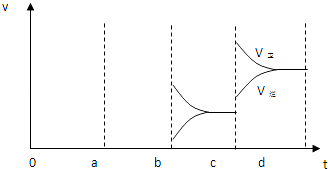 ,
,
所以答案是:升温;减小SO3浓度;
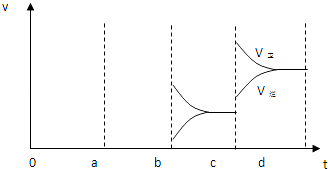 ;
;
(3)在(I)条件下w(HI)的变化如曲线Ⅰ所示,反应时间缩短,碘化氢的含量不变,说明该条件只增大了反应速率不影响平衡,增大压强和加入催化剂对该反应平衡无影响,但都增大反应速率,缩短反应时间,则甲条件可能是③⑤符合;
在(III)条件下w(HI)的变化如曲线(Ⅲ) 所示,反应时间变长,碘化氢的含量不变,说明反应速率减小,平衡不移动,所以是减小压强,即扩大容器体积,则乙条件可能是④符合,
所以答案是:③⑤;④.
【考点精析】根据题目的已知条件,利用化学平衡的计算的相关知识可以得到问题的答案,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对于工业合成氨反应:N2+3H22NH3 , 下列说法错误的是( )
A.使用合适的催化剂可以加大反应速率
B.升高温度可以增大反应速率
C.增大N2浓度可以使H2转化率达到100%
D.增大N2浓度可以增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素的原子随着原子序数的递增,有关递变不正确的是( )
A.最高正价:P<S<Cl<Ar
B.金属性:Na<K<Rb<Cs
C.原子半径:C>N>O>F
D.最外层电子数:Na<Mg<Al<Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
![]()
A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】着色剂是使食品着色的物质,可增加对食品的嗜好及刺激食欲。红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示。下列说法正确的是

A. 红斑素和红曲素互为同分异构体
B. 一定条件下红斑素和红曲素都能发生加聚和缩聚反应
C. 红斑素中含有醚键、羰基、酯基这三种含氧官能团
D. 1 mol红曲素最多能与6 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程图如下:
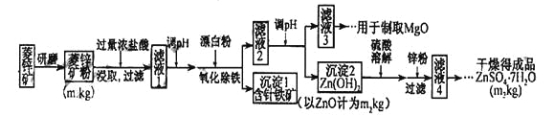
(1)将菱锌矿研磨成粉的目的是___________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+ □____+ □_____="=" □Fe(OH)3+ □Cl_
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H ,化学式式量为89,化学式是_______ 。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______ 。
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
Ksp | 5.6×10-12 | — | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是_________(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为 ______ 、_______ 、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnC3的质量分数不低于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=12的氢氧化钠溶液和pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是( )
A.混合后的溶液中c(Na+)=c(CH3COO-)
B.混合前的醋酸约1%发生电离
C.氢氧化钠和醋酸的浓度不相等
D.混合后的溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com