
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | ⑩ |
请回答下列问题:
(1)表中⑨号属于______ 区元素。
(2)表中元素③的2个原子与元素①的2个原子形成的某种直线型分子名称为 ________ ; ③和⑧形成的一种常见溶剂,其分子立体空间构型为________ 。
(3)元素①和⑥形成的最简单分子X属于 ________ 分子(填“极性”或“非极性”)。
(4)元素⑥的第一电离能 ________ 元素⑦的第一电离能;元素②的电负性________ 元素④的电负性(选填“>”、“=”或“<”)。
(5)元素⑨的基态原子核外价电子排布式是 ________ 。
(6)元素⑧和④形成的化合物的电子式为 ________ 。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素⑩与元素⑤的氢氧化物有相似的性质。请写出元素⑩的氢氧化物与NaOH溶液反应的化学方程式:________________________________________________________。
【答案】ds 乙炔 正四面体型 极性 > > 3d104s1 ![]() Zn(OH)2+2NaOH=Na2ZnO2+2H2O (或Zn(OH)2+2NaOH=Na2[Zn(OH)4] )
Zn(OH)2+2NaOH=Na2ZnO2+2H2O (或Zn(OH)2+2NaOH=Na2[Zn(OH)4] )
【解析】
根据元素周期表位置分析①为H ②为Be ③为C④Mg⑤Al⑥P⑦S⑧Cl⑨Cu⑩Zn。
(1)表中⑨号Cu属于ds区元素,故答案为:ds。
(2)2个C和2个H形成的直线型分子为C2H2,名称为乙炔,③和⑧形成的一种常见溶剂为CCl4,CCl4空间构型为正四面体型,故答案为:乙炔;正四面体型。
(3)元素①和⑥形成的最简单分子为PH3,PH3分子空间构型为三角锥形,正负电荷中心不重合,为极性分子,故答案为:极性。
(4)同一周期从左往右,第一电离能有逐渐增大的趋势,P的外围电子排布为3s23p3,p轨道处于半充满状态,第一电离能大于S的;同一主族,从上往下,元素电负性逐渐减小,元素②的电负性大于元素④的电负性,故答案为:>;>。
(5)⑨为Cu,原子序数为29,基态原子核外价电子排布式是3d104s1,故答案为:3d104s1。
(6)元素⑧和④形成的化合物为MgCl2,电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(7)元素⑩的氢氧化物为Zn(OH)2,仿Al(OH)3与NaOH溶液反应的化学方程式,Zn(OH)2与NaOH溶液反应的化学方程式:Zn(OH)2+2NaOH=Na2ZnO2+2H2O (或Zn(OH)2+2NaOH=Na2[Zn(OH)4] ),故答案为:Zn(OH)2+2NaOH=Na2ZnO2+2H2O (或Zn(OH)2+2NaOH=Na2[Zn(OH)4] )。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图。请回答下列问题:

(1)图中甲池中OH-移向_________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:__________________________________
(3)A电极的名称是_____ , 乙池中反应的化学方程式为_____________。若要使溶液恢复电解前的状态,应向乙池中加入________(写化学式)。
(4)当乙池中B(Ag)极质量增加10.8g,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出某金属,则丙池中的某盐溶液可能是____________
A. MgSO4 B.CuSO4 C.NaCl D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是

A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. YM3、WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在玻璃生产中,熔炉里原料发生的主要反应为:2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+3CO2↑。
2Na2SiO3+CaSiO3+3CO2↑。
(1)某反应物在熔融状态下不导电,它属于______晶体。
(2)上述反应里所涉及的短周期元素原子半径由大到小的顺序为________。
(3)碳和硅属于同族元素,该族元素的原子最外层电子的价层电子表示式为________。
(4)写一个能比较碳元素和氧元素非金属性强弱的化学反应方程式:________。
(5)CO2的电子式为_______。
(6)反应物Na2CO3与CaCO3均能制备二氧化碳,但是往往不是都能使用稀硫酸,请说明理由。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及一些化合物在工农业生产等领域有重要应用,回答下列问题
(1)羟胺 ( 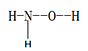 ) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
) 是不稳定的白色大片状或针状结晶。极易吸潮,极易溶于水。
①羟胺分子中采用sp3杂化的原子是____________________;羟胺极易溶于水,主要原因是________________________________。
②在羟胺的组成的元素中,处于同一周期元素的第四电离能(I4)较大的是______________(用元素符号表示)。
(2) 吡啶![]() 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有![]() 键的物质的量为_________ mol。
键的物质的量为_________ mol。
(3)已知:每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
①NO2 + CO ![]() CO2 + NO
CO2 + NO
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的“锂-呼吸CO2电池”,结构如图所示,下列说法不正确的是
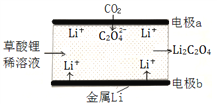
A. 该装置是化学能转变为电能
B. 利用该技术可减少温室气体CO2的排放
C. 正极的电极反应为:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+从正极迁移至负极
【答案】D
【解析】A、该装置为原电池装置,将化学能转化为电能,故A正确;B、由图可知,CO2转化为C2O42-,可减少温室气体的排放,故B正确;C、CO2→C2O42-,碳元素化合价降低,得电子,则CO2在正极发生反应,电极反应为:2CO2 +2e-=C2O42-,故C正确;D、原电池中,阳离子向正极移动,故D错误。故选D。
【题型】单选题
【结束】
27
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
A. 加催化剂B. 充入CO增大压强C. 充入N2D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F的核电荷数依次增大,且均为核电荷数小于18的非稀有气体元素。A的单质是自然界中密度最小的气体,A和C可形成A2C和A2C2两种常见的液态化合物,B、C原子的最外层电子数之和等于11,D+与C的简单离子的核外电子排布相同,C、E原子的最外层电子数相同。请回答下列问题:
(1)写出元素符号:B______,D______。
(2)A元素具有两个中子的核素的表示符号为_____,E的简单离子的结构示意图是______。
(3)A2C2的分子式为________。
(4)将少量F的单质通入足量氢氧化钠溶液中,发生反应的离子方程式是_________________________________________________。
(5)标准状况下,试管中收集满F的简单氢化物后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内溶液中溶质的物质的量浓度为____________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com