
【题目】A、B、C、D、E、F的核电荷数依次增大,且均为核电荷数小于18的非稀有气体元素。A的单质是自然界中密度最小的气体,A和C可形成A2C和A2C2两种常见的液态化合物,B、C原子的最外层电子数之和等于11,D+与C的简单离子的核外电子排布相同,C、E原子的最外层电子数相同。请回答下列问题:
(1)写出元素符号:B______,D______。
(2)A元素具有两个中子的核素的表示符号为_____,E的简单离子的结构示意图是______。
(3)A2C2的分子式为________。
(4)将少量F的单质通入足量氢氧化钠溶液中,发生反应的离子方程式是_________________________________________________。
(5)标准状况下,试管中收集满F的简单氢化物后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内溶液中溶质的物质的量浓度为____________mol·L-1。
【答案】N Na ![]() H(或T)
H(或T) ![]() H2O2 Cl2+2OH-===Cl-+ClO-+H2O 0.045(或
H2O2 Cl2+2OH-===Cl-+ClO-+H2O 0.045(或![]() )
)
【解析】
A、B、C、D、E、F为原子序数依次增大的六种短周期主族元素,A单质是自然界中密度最小的气体为氢气,A为H元素,A和C可形成A2C和A2C2两种常见的液态化合物,为H2O、H2O2,C为O元素,D+与C的简单离子核外电子排布相同,可知为Na+,D为Na元素,B、C的最外层电子数之和等于11,B为N元素,且C、E同主族,E为S,则F为Cl,以此解答该题。
(1)根据分析可知B为N,D为Na;
(2)具有两个中子,则其质量数为1+2=3,所以符号为![]() H(或T);S原子得到两个电子形成S2-,结构示意图为
H(或T);S原子得到两个电子形成S2-,结构示意图为![]() ;
;
(3)A2C2的分子式为H2O2;
(4)氯气可以与氢氧化钠溶液反应生成次氯酸钠、氯化钠和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)NH3极易溶于水,所以一段时间后试管中会充满液体,设试管的体积为VL,则试管内氨气的物质的量为![]() ,最终形成的溶液的体积为VL,所以溶液的物质的量浓度为
,最终形成的溶液的体积为VL,所以溶液的物质的量浓度为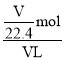 =0.045mol/L(或
=0.045mol/L(或![]() mol/L)。
mol/L)。


科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | ⑩ |
请回答下列问题:
(1)表中⑨号属于______ 区元素。
(2)表中元素③的2个原子与元素①的2个原子形成的某种直线型分子名称为 ________ ; ③和⑧形成的一种常见溶剂,其分子立体空间构型为________ 。
(3)元素①和⑥形成的最简单分子X属于 ________ 分子(填“极性”或“非极性”)。
(4)元素⑥的第一电离能 ________ 元素⑦的第一电离能;元素②的电负性________ 元素④的电负性(选填“>”、“=”或“<”)。
(5)元素⑨的基态原子核外价电子排布式是 ________ 。
(6)元素⑧和④形成的化合物的电子式为 ________ 。
(7)某些不同族元素的性质也有一定的相似性,如上表中元素⑩与元素⑤的氢氧化物有相似的性质。请写出元素⑩的氢氧化物与NaOH溶液反应的化学方程式:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ⑩ | ② | |||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
四 | ⑧ | ⑨ |
(1)在这些元素中,最活泼的非金属元素是___(元素符号),原子最外层达到稳定结构的元素是__(元素符号);
(2)元素的最高价氧化物对应的水化物中酸性最强的是____(填化学式);
(3)写出④的氧化物与③的最高价氧化物对应的水化物相互反应的化学方程式_____;
(4)③、⑥、⑧的原子半径由大到小为__﹥___﹥__/span>(填元素符号)①、⑤的最高价含氧酸酸性__﹥__(均填化学式);
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式________;
(6)写出实验室制备⑩的氢化物的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol/L盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。已知:
①加入固体A的质量m≤3.2 g时,收集到的气体为H2;
②当m>3.2 g时,收集到的气体为H2和H2S的混合气体。
⑴3.2 g固体A中所含的物质有______________。
⑵3.2 g固体A中各物质的物质的量分别为______________,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为______________(忽略溶液体积的变化)。
⑶当固体A全部溶于上述盐酸,且A的质量m>3.2 g时,收集到的气体体积(标准状况下)V=______________mL(用含m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
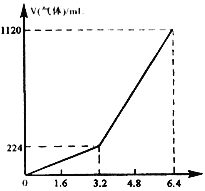
【题目】浓度均为0.10 mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积为V,pH随lg![]() 的变化如图所示。下列叙述错误的是( )
的变化如图所示。下列叙述错误的是( )
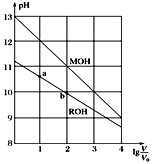
A. 当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
B. MOH的碱性强于ROH的碱性
C. ROH的电离程度:b点大于a点
D. 若两溶液无限稀释,则它们的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式为:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
(1)反应物HCl中氯元素的化合价为___。
(2)在该氧化还原反应中,MnO2做___剂,锰元素被___,而HCl在反应中表现的性质包括___和___。
(3)若有6molCl2生成时,反应中转移___mol电子。
(4)写出该反应的离子方程式___,用双线桥法标出电子转移的方向和数目:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农业对化肥的需求是合成氨工业发展的持久推动力。在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
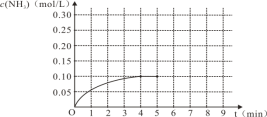
(1)N2(g)+3H2(g)![]() 2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图像,计算从反应开始到平衡时,氮气的平均反应速率为___________________。
2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图像,计算从反应开始到平衡时,氮气的平均反应速率为___________________。
(2)该温度下,反应N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式为__________。
2NH3(g)+ Q(Q>0)的平衡常数表达式为__________。
其平衡常数K与温度T的关系如下表:
T/℃ | 25 | 125 | 225 |
平衡常数K | 4×106 | K1 | K2 |
试判断K1______ K2(填写“>”“=”或“<”)。原因是_________________________________
(3)下列能说明合成氨反应已达到平衡状态的是________(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2) b. ![]() 不发生变化 c.混合气体的密度保持不变
不发生变化 c.混合气体的密度保持不变
d.25℃时,测得容器中 c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
(4) 催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式并标出电子转移的方向和数目:____________;该反应中氧化产物与还原产物的物质的量之比为____。
(5) pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为____g,假设广口瓶里生成一种正盐,其质量为______g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)该燃料中碳、氢元素质量比为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷、乙烯、乙炔它们及其衍生物一氯乙烷、氯乙烯、乙醇、乙醛、乙酸、乙酸乙酯都有很重要的用途。
(1)乙炔通入溴水的现象________;由乙烷制取一氯乙烷的反应条件_________;由乙烯制取乙醇的反应类型__________。
(2)一氯乙烷分子中的官能团为_________,聚氯乙烯的结构简式为__________。
(3)写出由乙醇生成乙烯的化学反应方程式__________。
(4)写出乙酸的一种同分异构体的结构简式_________,检验该同分异构体是否含有醛基操作__________。
(5)乙二醇(HOCH2CH2OH)也是一种很重要的化工原料,请完成由一氯乙烷合成乙二醇的路线图。(合成路线常用的表示方式为:A![]() 目标产物)。___________。
目标产物)。___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com