
【题目】下表是元素周期表的一部分,请回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ⑩ | ② | |||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
四 | ⑧ | ⑨ |
(1)在这些元素中,最活泼的非金属元素是___(元素符号),原子最外层达到稳定结构的元素是__(元素符号);
(2)元素的最高价氧化物对应的水化物中酸性最强的是____(填化学式);
(3)写出④的氧化物与③的最高价氧化物对应的水化物相互反应的化学方程式_____;
(4)③、⑥、⑧的原子半径由大到小为__﹥___﹥__/span>(填元素符号)①、⑤的最高价含氧酸酸性__﹥__(均填化学式);
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式________;
(6)写出实验室制备⑩的氢化物的化学方程式_________。
【答案】F Ar HClO4 Al2O3+2NaOH=2NaAlO2+H2O K Na Cl H2CO3 H2SiO3或H4SiO4 2NaBr+Cl2=2NaCl+Br2 2NH4C1+Ca(OH)2 ![]() 2NH3↑+CaC12+2H2O
2NH3↑+CaC12+2H2O
【解析】
根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是C、F、Na、Al、Si、Cl、Ar、K、Br、N元素。
(1)最活泼的非金属元素在周期表右上角(稀有气体除外),原子最外层达到稳定结构的元素是稀有气体元素;
(2)元素的非金属性越强,元素的最高价氧化物对应的水化物酸性越强(O、F除外);
(3)④的氧化物为氧化铝,③的最高价氧化物对应的水化物是NaOH,二者反应生成NaAlO2,据此书写反应的方程式;
(4)原子的电子层数越多,原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,据此排序;元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(5)根据非金属性强弱的判断方法分析解答;
(6)⑩的氢化物为NH3,实验室用氯化铵和氢氧化钙加热制取氨气,据此书写反应的方程式。
根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是C、F、Na、Al、Si、Cl、Ar、K、Br、N元素。
(1)在这些元素中,最活泼的非金属元素在周期表右上角(稀有气体除外),为F元素,原子最外层达到稳定结构的元素是稀有气体元素,为Ar元素,故答案为:F;Ar;
(2)元素的非金属性越强,元素的最高价氧化物对应的水化物酸性越强(O、F除外),非金属性最强的是Cl元素,所以HClO4是酸性最强的酸,故答案为:HClO4;
(3)④的氧化物为氧化铝,③的最高价氧化物对应的水化物是NaOH,二者反应生成NaAlO2,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(4)原子的电子层数越多,原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,所以③、⑥、⑧的原子半径由大到小的顺序为K>Na>Cl;元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性C>Si,所以其最高价氧化物的水化物酸性H2CO3>H2SiO3或H4SiO4,故答案为:K;Na;Cl;H2CO3;H2SiO3或H4SiO4;
(5)氯气能和溴离子发生氧化还原反应生成溴,反应的化学方程式为2NaBr+Cl2=2NaCl+Br2,能够证明非金属性Cl比Br强,故答案为:2NaBr+Cl2=2NaCl+Br2;
(6)⑩的氢化物为NH3,在加热条件下,氯化铵和氢氧化钙反应生成氯化钙、水和氨气,反应的化学方程式:2NH4C1+Ca(OH)2 ![]() 2NH3↑+CaC12+2H2O;故答案为:2NH4C1+Ca(OH)2
2NH3↑+CaC12+2H2O;故答案为:2NH4C1+Ca(OH)2 ![]() 2NH3↑+CaC12+2H2O。
2NH3↑+CaC12+2H2O。


科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图。请回答下列问题:

(1)图中甲池中OH-移向_________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:__________________________________
(3)A电极的名称是_____ , 乙池中反应的化学方程式为_____________。若要使溶液恢复电解前的状态,应向乙池中加入________(写化学式)。
(4)当乙池中B(Ag)极质量增加10.8g,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出某金属,则丙池中的某盐溶液可能是____________
A. MgSO4 B.CuSO4 C.NaCl D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的“锂-呼吸CO2电池”,结构如图所示,下列说法不正确的是
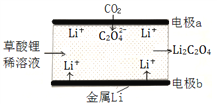
A. 该装置是化学能转变为电能
B. 利用该技术可减少温室气体CO2的排放
C. 正极的电极反应为:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+从正极迁移至负极
【答案】D
【解析】A、该装置为原电池装置,将化学能转化为电能,故A正确;B、由图可知,CO2转化为C2O42-,可减少温室气体的排放,故B正确;C、CO2→C2O42-,碳元素化合价降低,得电子,则CO2在正极发生反应,电极反应为:2CO2 +2e-=C2O42-,故C正确;D、原电池中,阳离子向正极移动,故D错误。故选D。
【题型】单选题
【结束】
27
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
A. 加催化剂B. 充入CO增大压强C. 充入N2D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.SO2是造成空气污染的主要原因之一,可以Na2SO3溶液为吸收液除SO2。
(1)该反应的离子方程式是_____________________________________________________。
(2)已知NaHSO3溶液显酸性,请结合离子方程式,用盐的水解和电离理论进行解释:_______________________________________________________________________。
(3)在Na2SO3稀溶液中各离子浓度从大到小排列顺序是___________________________。
(4)往Na2SO3稀溶液加入少量KOH固体,完全溶解后(忽略溶解过程中溶液温度变化)溶液中c(Na+) : c(SO32-) 的比值____________(填“变大”、“变小”或“保持不变”)。
II.工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2。
(5)写出该反应的化学方程式为_______________________。
(6)上述反应中,每减少2.24L气体(标准状况下),转移电子数为_____。
(7)上述反应所涉及的3种元素中,原子半径从大到小的排列顺序为_________;三种元素非金属性由强到弱的顺序为____________;反应所涉及的化合物中仅有一种是非极性分子,其电子式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,不正确的是( )
H++CH3COO-,不正确的是( )
A. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B. 常温下0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是
A.大理石和稀盐酸B.Ca(OH)2和NH4Cl
C.Cu和浓硝酸D.MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F的核电荷数依次增大,且均为核电荷数小于18的非稀有气体元素。A的单质是自然界中密度最小的气体,A和C可形成A2C和A2C2两种常见的液态化合物,B、C原子的最外层电子数之和等于11,D+与C的简单离子的核外电子排布相同,C、E原子的最外层电子数相同。请回答下列问题:
(1)写出元素符号:B______,D______。
(2)A元素具有两个中子的核素的表示符号为_____,E的简单离子的结构示意图是______。
(3)A2C2的分子式为________。
(4)将少量F的单质通入足量氢氧化钠溶液中,发生反应的离子方程式是_________________________________________________。
(5)标准状况下,试管中收集满F的简单氢化物后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内溶液中溶质的物质的量浓度为____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线:
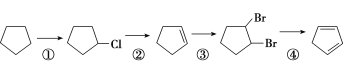
(1)反应①的产物名称是________,反应的化学方程式为___________________。
(2)反应②的反应试剂和反应条件是________,反应③的反应类型是________。
(3)![]() 与NaOH水溶液反应的化学方程式________________________。
与NaOH水溶液反应的化学方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com