
【题目】浓度均为0.10 mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积为V,pH随lg![]() 的变化如图所示。下列叙述错误的是( )
的变化如图所示。下列叙述错误的是( )
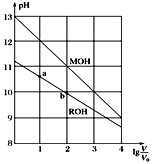
A. 当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
B. MOH的碱性强于ROH的碱性
C. ROH的电离程度:b点大于a点
D. 若两溶液无限稀释,则它们的c(OH-)相等
【答案】A
【解析】
A.升高温度促进弱电解质电离;
B.浓度都是0.10mol/L的这两种碱溶液未加水稀释前,MOH的pH=13,说明MOH溶液中c(OH-)=c(MOH)=0.1mol/L,则MOH是强电解质;ROH溶液的pH=11,说明ROH溶液中c(OH-)<c(ROH)=0.1mol/L,则ROH是弱电解质;
C.弱酸溶液中酸的浓度越小,其电离程度越大;
D.若两溶液无限稀释,则它们水溶液接近中性。
A.升高温度促进弱电解质电离,MOH是强电解质,升高温度不影响其电离,ROH是弱电解质,升高温度促进其电离,所以当1g![]() =2时,若两溶液同时升温,则
=2时,若两溶液同时升温,则![]() 减小,A错误;
减小,A错误;
B.浓度都是0.10mol/L的这两种碱溶液未加水稀释前,MOH的pH=13,说明MOH溶液中c(OH-)=c(MOH)=0.1mol/L,则MOH是强电解质;ROH溶液的pH=11,说明ROH溶液中 c(OH-)<c(ROH)=0.1mol/L,则ROH是弱电解质,所以MOH的碱性强于ROH的碱性,B正确;
C.弱酸溶液中酸的浓度越小,其电离程度越大,a溶液浓度大于b,所以ROH的电离程度a<b,C正确;
D.若两溶液无限稀释,则它们水溶液接近中性,则两种溶液中它们的c(OH-)相等,D正确;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】在玻璃生产中,熔炉里原料发生的主要反应为:2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+3CO2↑。
2Na2SiO3+CaSiO3+3CO2↑。
(1)某反应物在熔融状态下不导电,它属于______晶体。
(2)上述反应里所涉及的短周期元素原子半径由大到小的顺序为________。
(3)碳和硅属于同族元素,该族元素的原子最外层电子的价层电子表示式为________。
(4)写一个能比较碳元素和氧元素非金属性强弱的化学反应方程式:________。
(5)CO2的电子式为_______。
(6)反应物Na2CO3与CaCO3均能制备二氧化碳,但是往往不是都能使用稀硫酸,请说明理由。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.SO2是造成空气污染的主要原因之一,可以Na2SO3溶液为吸收液除SO2。
(1)该反应的离子方程式是_____________________________________________________。
(2)已知NaHSO3溶液显酸性,请结合离子方程式,用盐的水解和电离理论进行解释:_______________________________________________________________________。
(3)在Na2SO3稀溶液中各离子浓度从大到小排列顺序是___________________________。
(4)往Na2SO3稀溶液加入少量KOH固体,完全溶解后(忽略溶解过程中溶液温度变化)溶液中c(Na+) : c(SO32-) 的比值____________(填“变大”、“变小”或“保持不变”)。
II.工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2。
(5)写出该反应的化学方程式为_______________________。
(6)上述反应中,每减少2.24L气体(标准状况下),转移电子数为_____。
(7)上述反应所涉及的3种元素中,原子半径从大到小的排列顺序为_________;三种元素非金属性由强到弱的顺序为____________;反应所涉及的化合物中仅有一种是非极性分子,其电子式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是
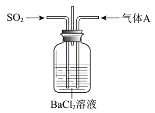
A.大理石和稀盐酸B.Ca(OH)2和NH4Cl
C.Cu和浓硝酸D.MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
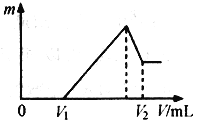
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160mL时,则金属粉末中n(Mg)=______________mol,V2=______________mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)_________mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F的核电荷数依次增大,且均为核电荷数小于18的非稀有气体元素。A的单质是自然界中密度最小的气体,A和C可形成A2C和A2C2两种常见的液态化合物,B、C原子的最外层电子数之和等于11,D+与C的简单离子的核外电子排布相同,C、E原子的最外层电子数相同。请回答下列问题:
(1)写出元素符号:B______,D______。
(2)A元素具有两个中子的核素的表示符号为_____,E的简单离子的结构示意图是______。
(3)A2C2的分子式为________。
(4)将少量F的单质通入足量氢氧化钠溶液中,发生反应的离子方程式是_________________________________________________。
(5)标准状况下,试管中收集满F的简单氢化物后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内溶液中溶质的物质的量浓度为____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是_____________
(2)A池中Zn是_____极,电极反应式为________;Cu是______极,电极反应式为______________,A中总反应的方程式为________________________。
(3)B池中总反应的方程式为________________。
(4)C池中Zn是____极,电极反应式为_____;Cu是______极,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种物质AC2(气体)、B2C2、AD4,元素A的最高正价和负价绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子相同,则:
(1)AC2、AD4的化学式分别为______、______。
(2)AD4分子其中含有的σ键类型为_______(填“s-s σ键”“s-p σ键”或“p-p σ键”)。
(3)D的负一价阴离子的电子排布式为_________,B2C2的电子式为__________,属___________(填“离子化合物”或“共价化合物”)。
(4)写出一种与AC互为等电子体的分子______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
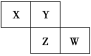
A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应容易
D. X的原子半径小于Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com