
【题目】向某容积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答下列问题。
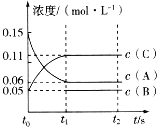
(1)密闭容器的容积是___L。
(2)若t1=15s,则t0~t1阶段以C物质浓度变化表示的反应速率为v(C)=___。
(3)写出反应的化学方程式:___。
(4)B的起始物质的量是___。
【答案】2 0.004mol·L-1·s-1 3A(g)![]() B(g)+2C(g) 0.04mol
B(g)+2C(g) 0.04mol
【解析】
由图可知,A为反应物、C为生成物,由物质的量之比等于化学计量数之比可得A、C的化学计量数之比为(0.15—0.06):(0.11—0.05)=3:2,由反应过程中混合气体的平均相对分子质量没有变化可知,B为生成物,A、B、C的化学计量数之比为3:1:2,反应的化学方程式为3A(g)![]() B(g)+2C(g)。
B(g)+2C(g)。
(1)由题意可知,A的物质的量为0.3mol,由图可知A的浓度为0.15mol/L,则容器的体积为![]() =2L,故答案为:2;
=2L,故答案为:2;
(2)由图可知,t0~t1阶段生成物C的浓度变化为0.11mol·L-1-0.05mol·L-1=0.06mol·L-1,则C的反应速率![]() ,故答案为:0.004mol·L-1·s-1;
,故答案为:0.004mol·L-1·s-1;
(3) 由图可知,A为反应物、C为生成物,由物质的量之比等于化学计量数之比可得A、C的化学计量数之比为(0.15—0.06):(0.11—0.05)=3:2,由反应过程中混合气体的平均相对分子质量没有变化可知,B为生成物,A、B、C的化学计量数之比为3:1:2,反应的化学方程式为3A(g)![]() B(g)+2C(g),故答案为:3A(g)
B(g)+2C(g),故答案为:3A(g)![]() B(g)+2C(g);
B(g)+2C(g);
(4)根据化学方程式3A(g)![]() B(g)+2C(g)可知,B的物质的量的变化是C的一半,故B的物质的量的变化0.06mol,因此B的起始物质的量是0.05mol·L-1×2L-0.06mol=0.04mol,故答案为:0.04mol。
B(g)+2C(g)可知,B的物质的量的变化是C的一半,故B的物质的量的变化0.06mol,因此B的起始物质的量是0.05mol·L-1×2L-0.06mol=0.04mol,故答案为:0.04mol。


科目:高中化学 来源: 题型:
【题目】右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象描述正确的是

A. 逸出气体的体积,a电极的小于b电极的
B. 一电极逸出无味气体,另一电极逸出刺激性气体
C. a电极附近呈红色,b电极附近呈蓝色
D. a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在玻璃生产中,熔炉里原料发生的主要反应为:2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+3CO2↑。
2Na2SiO3+CaSiO3+3CO2↑。
(1)某反应物在熔融状态下不导电,它属于______晶体。
(2)上述反应里所涉及的短周期元素原子半径由大到小的顺序为________。
(3)碳和硅属于同族元素,该族元素的原子最外层电子的价层电子表示式为________。
(4)写一个能比较碳元素和氧元素非金属性强弱的化学反应方程式:________。
(5)CO2的电子式为_______。
(6)反应物Na2CO3与CaCO3均能制备二氧化碳,但是往往不是都能使用稀硫酸,请说明理由。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的“锂-呼吸CO2电池”,结构如图所示,下列说法不正确的是
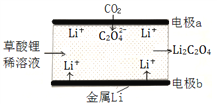
A. 该装置是化学能转变为电能
B. 利用该技术可减少温室气体CO2的排放
C. 正极的电极反应为:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+从正极迁移至负极
【答案】D
【解析】A、该装置为原电池装置,将化学能转化为电能,故A正确;B、由图可知,CO2转化为C2O42-,可减少温室气体的排放,故B正确;C、CO2→C2O42-,碳元素化合价降低,得电子,则CO2在正极发生反应,电极反应为:2CO2 +2e-=C2O42-,故C正确;D、原电池中,阳离子向正极移动,故D错误。故选D。
【题型】单选题
【结束】
27
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列氧化还原反应相关问题:
I.配平下面的氧化还原方程式:_______
___ Na2SO3+____ KIO3+____ H2SO4 =____ Na2SO4+____ K2SO4+____ I2+____ H2O
II.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为
![]() (浓)
(浓)![]()
![]() 。
。
(1)请分析该反应中电子转移的情况(用双线桥表示)_______________。
(2)浓盐酸在反应中显示出来的性质是________(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
若标准状况下产生4.48L Cl2,则参加反应的KClO3的质量为_______g,被氧化的盐酸的物质的量为________mol,转移电子的物质的量为________mol。
(3)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的________倍。(提示:ClO2与Cl2消毒时氯元素都被还原为最低价)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
A. 加催化剂B. 充入CO增大压强C. 充入N2D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.SO2是造成空气污染的主要原因之一,可以Na2SO3溶液为吸收液除SO2。
(1)该反应的离子方程式是_____________________________________________________。
(2)已知NaHSO3溶液显酸性,请结合离子方程式,用盐的水解和电离理论进行解释:_______________________________________________________________________。
(3)在Na2SO3稀溶液中各离子浓度从大到小排列顺序是___________________________。
(4)往Na2SO3稀溶液加入少量KOH固体,完全溶解后(忽略溶解过程中溶液温度变化)溶液中c(Na+) : c(SO32-) 的比值____________(填“变大”、“变小”或“保持不变”)。
II.工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2。
(5)写出该反应的化学方程式为_______________________。
(6)上述反应中,每减少2.24L气体(标准状况下),转移电子数为_____。
(7)上述反应所涉及的3种元素中,原子半径从大到小的排列顺序为_________;三种元素非金属性由强到弱的顺序为____________;反应所涉及的化合物中仅有一种是非极性分子,其电子式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是
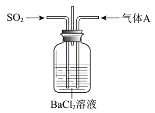
A.大理石和稀盐酸B.Ca(OH)2和NH4Cl
C.Cu和浓硝酸D.MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种物质AC2(气体)、B2C2、AD4,元素A的最高正价和负价绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子相同,则:
(1)AC2、AD4的化学式分别为______、______。
(2)AD4分子其中含有的σ键类型为_______(填“s-s σ键”“s-p σ键”或“p-p σ键”)。
(3)D的负一价阴离子的电子排布式为_________,B2C2的电子式为__________,属___________(填“离子化合物”或“共价化合物”)。
(4)写出一种与AC互为等电子体的分子______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com