
����Ŀ��������������ʹ�õ�ϡ�����������㷺Ӧ���ڵ��Ӳ�Ʒ�С������������������Ҫԭ������ϡ�������ϡ��������������Լ��������ʡ���ش��������⣺
(1)��(Nd)Ϊ60��Ԫ�أ���Ԫ�����ڱ���λ�ڵ�____���ڣ���̬Fe2����Χ���ӵĹ������ʽΪ_____________��
(2)ʵ����AlCl3��ʵ�ʴ�����ʽΪAl2Cl6������ӵ����ģ����ͼ��ʾ��

�ٸ÷�����Alԭ�Ӳ�ȡ______�ӻ���
��Al2Cl6�����NaOH��Һ��Ӧ����Na[Al(OH)4]��[Al(OH)4]���д��ڵĻ�ѧ����____�����ţ���
A�����Ӽ�����B�����Թ��ۼ�����C������������D���Ǽ��Թ��ۼ�����E�����
(3)FeO�����Ӿ��壬�侧���ܿ�ͨ�����µ�Born��Haberѭ������õ���

��̬Feԭ�ӵĵ�һ������Ϊ___kJ��mol-1��FeO�ľ�����Ϊ___kJ��mol-1��
(4)������к��д������Ϻ�����������ʴ�������������һ�����㣬��ͨ�������(Ni)�Ƚ��б���Ϳ�㴦������֪Ni�����γɻ��������ʻ�����Ni(CO)4�ݣ���Ϊ��ɫ�ӷ��綾Һ�壬�۵�Ϊ��25 �棬�е�Ϊ43 �棬������ˮ���������Ҵ����������Ȼ�̼���л��ܼ������ʻ����ľ���������_______��д�������廥Ϊ�ȵ�����ķ��Ӻ����ӵĻ�ѧʽΪ_____��_____����дһ�֣���
(5)��֪����BN����Ӳ�Ⱥܴ���ԭ����________���侧���ṹ��ͼ��ʾ���辧���������B��Nԭ��֮��ľ���Ϊa nm�������ӵ�������ֵΪNA��������ܶ�Ϊ_____g��cm-3����ʽ���ɣ��ú�a��NA�Ĵ���ʽ��ʾ����

���𰸡��� ![]() sp3 B 762.5 3902 ���Ӿ��� N2 CN- ����BN������ԭ�Ӿ��壬B-N�����ܴ������ʵؼ�Ӳ
sp3 B 762.5 3902 ���Ӿ��� N2 CN- ����BN������ԭ�Ӿ��壬B-N�����ܴ������ʵؼ�Ӳ ![]()
��������
(1)NdΪ60��Ԫ�أ����ݸ��������а�����Ԫ��������Ŀ��Ԫ�����ڱ��ṹȷ�������ڵ�λ�ã����ݹ���ԭ����дFe2+��������Ų������ù������ʽ���
(2)��A12C16Ϊ˫�۷��ӽṹʽ������ͼ֪��ÿ��Alԭ�Ӽ۲���ӶԸ�����4�����ݼ۲���ӶԻ��������ж�Alԭ���ӻ����ͣ�
��[Al(OH)4]����Al���Ӻ�Oԭ��֮�������λ����O-Hԭ��֮����ڼ��Լ�����λ��Ҳ���ڹ��ۼ���
(3)���ݵ�һ�����ܺ;����ܵĶ��壬���ͼʾ���ݽ��
(4)���ݾ���������ж��侧�����ͣ���ϵȵ����庬����д����CO��Ϊ�ȵ�����ķ��Ӻ����ӵĻ�ѧʽ��
(5)��֪����BN����Ӳ�Ⱥܴ�˵��ԭ��֮����������ǿ������ԭ�Ӿ��壬�þ�̯���������ܶȼ��㹫ʽ����NA��ֵ��
(1) NdΪ60��Ԫ�أ�����Ԫ�����ڱ��и������ڰ�����Ԫ��������Ŀ�ֱ���2��8��8��18��18��32��32����NdΪ�������ڵ�IIIB�壬Fe��26��Ԫ�أ�ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d64s2����Fe2+��������Ų�Ϊ1s22s22p63s23p63d6���۲���ӵĹ������ʽΪ��![]() ��
��
(2)��A12C16Ϊ˫�۷��ӽṹʽ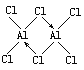 ������ͼ֪��ÿ��Alԭ�Ӽ۲���ӶԸ�����4�����ݼ۲���ӶԻ��������ж�Alԭ���ӻ�����Ϊsp3�ӻ���
������ͼ֪��ÿ��Alԭ�Ӽ۲���ӶԸ�����4�����ݼ۲���ӶԻ��������ж�Alԭ���ӻ�����Ϊsp3�ӻ���
��[Al(OH)4]����Al���Ӻ�Oԭ��֮�������λ����O-Hԭ��֮����ڼ��Լ�����λ��Ҳ���ڹ��ۼ����ʺ���ѡ����B��
(3)Feԭ�ӵĵ�һ������ΪFe(g)ԭ��ʧȥ1�������γ�Fe+(g)����Ҫ����������Fe�ĵ�һ������Ϊ��762.5 kJ/mol��FeO�������dz�Fe2+(g)��O2-(g)�γ�1 mol FeO�����ͷŵ�����������ͼʾ��֪FeO������Ϊ3902 kJ/mol��
(4)���������ʻ�����Ni(CO)4�ݣ���Ϊ��ɫ�ӷ��綾Һ�壬�۵�Ϊ-25�棬�е�Ϊ43�棬������ˮ���������Ҵ����������Ȼ�̼���л��ܼ���˵���乹����֮��������С�����з��Ӿ�����ص㣬�����ʻ����ľ��������Ƿ��Ӿ��壬���ʻ�����Ni(CO)4�ݵ���λ����CO������2��ԭ�ӣ���������Ϊ14�����Ը��ݵȵ�����ĺ����֪��CO��Ϊ�ȵ�����ķ���ΪN2������ΪCN-��
(5)����BN����Ӳ�Ⱥܴ���ԭ��������BN������ԭ�Ӿ��壬ԭ�Ӱ뾶С��B-N�����ܴ������ĺܸ����������ʵؼ�Ӳ���۷е�ߣ�
����BN����ṹ��֪����һ�������к��е�Nԭ����Ϊ��8��![]() +6��
+6��![]() =4�����е�Bԭ����ĿΪ4��1=4����һ�������к���4��BN�������������B��Nԭ��֮��ľ���Ϊa nm���þ�����ھ�����Խ��߳��ȵ�
=4�����е�Bԭ����ĿΪ4��1=4����һ�������к���4��BN�������������B��Nԭ��֮��ľ���Ϊa nm���þ�����ھ�����Խ��߳��ȵ�![]() ��������Խ��߳���=4a nm�������ⳤ=
��������Խ��߳���=4a nm�������ⳤ=![]() nm���������ΪV=(
nm���������ΪV=(![]() nm)3=(
nm)3=(![]() ��10-7cm)3�������ӵ�������ֵΪNA����=
��10-7cm)3�������ӵ�������ֵΪNA����=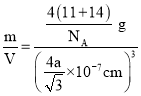 =
=![]() g/cm3��
g/cm3��


 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϊ̽��ͭ��ϡ���ᷴӦ����̬�������Ƿ�NO2����������ʵ�顣
��֪�� FeSO4+NO��[Fe(NO)]SO4���÷�Ӧ�ϻ�����������һ����[Fe(NO)]2+ʱͻ��������ɫ��

��1��ʵ��ǰ�����װ�õ������ԣ���������_____________________________________��
��2��ʵ�鿪ʼʱ�Ƚ�Y���Թ���ʢ��̼��Ƶ�֧����б����������ϡ���ᣬ��ʵ�������Ŀ����__________________________________________________________________��ͭƬ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ________________________________��
��3��ϴ��ƿ�м���KSCN��Һ��Ŀ�ļ�ԭ����______________________________________����ʵ��ֻ�۲쵽ϴ��ƿ�г�������ɫ��д��β�������Ļ�ѧ����ʽ________________��
��ʵ�����Ʊ���CuSO4��5H2O�г���Cu(NO3)2�����������ⶨCuSO4��5H2O�ĺ�����
��4��ʵ�鲽��Ϊ����___________�ڼ�ˮ�ܽ�ۼ��Ȼ�����Һ�������ܹ��ˣ����ಽ��ʡ�ԣ����ڹ���ǰ����Ҫ�����Ƿ������ȫ���������_________________________________��
��5����1.040 g�����к�CuSO4��5H2O��ȷֵΪ1.015 g����ʵ��ⶨ�����l.000 g �ⶨ��������Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ⱦ۱�ϩ�����Ͽ��Եõ�̼�����������顢��ϩ����ϩ�����ͼױ�������ͼ��ʾװ��̽���Ͼ����ϵ������á�������������ȷ����
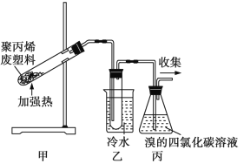
A.װ�����Թ����ռ�����Һ���ڴ��������¿�����Br2����ȡ����Ӧ
B.װ�ñ��е��Լ����շ�Ӧ�����������õ��IJ�����ܶȾ���ˮ��
C.����ռ������������Ϊ���ȼ��ʹ��
D.����Ķ��ȴ�����2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(Na2S2O5)�dz��õ�ʳƷ��������֮һ��ij�о�С���������ʵ�飺
ʵ��һ�����������Ƶ���ȡ
������ͼװ��(ʵ��ǰ�ѳ���װ���ڵĿ���)��ȡNa2S2O5��װ�â�����Na2S2O5���������������ķ�ӦΪNa2SO3��SO2![]() Na2S2O5��
Na2S2O5��
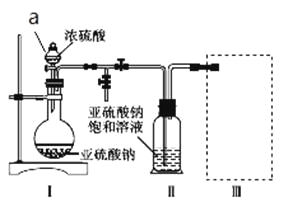
��1�����Լ�ǰҪ���еIJ�����_______________��װ�â��в�������Ļ�ѧ����ʽΪ____________��
��2��Ũ����_______________ (��ܡ����ܡ�)��ϡ������棬ԭ����_______________��
��3����װ�â��з������Ʒ�ɲ�ȡ�ķ��뷽����_______________________��
��4��Ϊ������ʵ��װ�ã�������װ����ѡ��һ���������װ�÷���װ�â���ѡ�õ�װ��(�г���������ȥ)Ϊ___________(�����)��
ʵ��������Ѿ��п��������������IJⶨ
��5�����ѾƳ���Na2S2O5�������������ⶨij���Ѿ��п��������IJ�����(������SO2����)�ķ������£�

(��֪���ζ�ʱ��Ӧ�Ļ�ѧ����ʽΪSO2��I2��2H2O![]() H2SO4��2HI)
H2SO4��2HI)
�ٰ���������ʵ�飬���ı�I2��Һ30.00 mL���ô�ʵ������Ʒ�п��������IJ�����(������SO2����)Ϊ________________g��L-1��
��������ʵ������У����в���HI��������������ⶨ���______________(�ƫ�ߡ�����ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˹��ը��ú���е��ش�Σ����һ����˹�����ǣ�ͼ�ף��Ĵ�������ú������еļ���ﵽһ��Ũ��ʱ������ʾ������˹�����ǹ���ԭ������ȼ�ϵ�صĹ���ԭ������װ����ͼ����ʾ��

���еĹ���������Y2O3��Na2O��O2�����������������ƶ��������й���������ȷ����
A.�缫b���������ڵ�·��O2���ɵ缫b����缫a
B.�缫a�ķ�ӦʽΪ��CH4 +4O2����8e����CO2 +2H2O
C.��˹�����ǹ���ʱ������ڵ�·�е����ɵ缫b����缫a
D.��������������1 mol O2�� ͨ��ʱ������ת��2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����
A. ̼���������Ũ���ᷴӦ:CaCO3+2H+![]() Ca2++H2O+CO2��
Ca2++H2O+CO2��
B. ����������Һ��ϡ���ᷴӦ:OH-+H+![]() H2O
H2O
C. �Ȼ�����Һ�������ˮ��Ӧ: A13++3OH-=A1(OH)3��
D. ����ˮ��Ӧ:Na+2H2O![]() Na++2OH-+H2��
Na++2OH-+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���صij�ŵ練ӦΪPb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1)��ijǦ���ص�����������DZ�ĥ����������װ�����ʵ�飬ʶ�����Ǧ���ص�����������
2PbSO4(s)+2H2O(1)��ijǦ���ص�����������DZ�ĥ����������װ�����ʵ�飬ʶ�����Ǧ���ص�����������
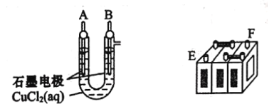
(1)��A��E��B��F��B�缫����_____________���缫��ӦʽΪ_____________��˵��FΪ������
(2)Ǧ���ع���ʱ(�ŵ�)��E�缫�ķ�ӦʽΪ_____________�����ʱ�ü�����ӵ�Դ��_____________��������
(3)����0.2mol���ӷ���ת�ƣ�����������PbO2�����ʵ�����______mol��
(4)��ͼ���ڽ���п��������һ����ij��Һ��ʪ����ֽ��
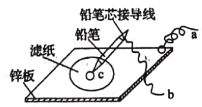
�����������ƺͷ�̪�Ļ����Һ��ʪ��ֽ���õ��߽�a��bֱ������������ֽ����____ɫ��Ǧ��оc�㴦�ĵ缫��ӦʽΪ________________��
������KI-������Һ��ʪ��ֽ���õ��߽�a��b��Ǧ���ص�E��F�缫������Ǧ��оc�㴦������ɫ����b�ӵ���_______(����E������F��)�缫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ�������г����Ľ�����ͭ���仯�����ڲ�ͬ�������ܳ��ֳ���ͬ����ɫ��
![]()
�ش��������⣺
��1��Cu��̬��������Ų�ʽΪ___����ѧ��ͨ��X���߲��Cu(H2O)4SO4��H2O�ṹʾ��ͼ�ɼ�ʾ��ͼ��

ͼ�����߱�ʾ��������Ϊ___��
��2����֪Cu+(SCN)2![]() Cu+(SCN)2��1mol(SCN)2�����к��е�������ĿΪ___��д��2����SCN-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ___��
Cu+(SCN)2��1mol(SCN)2�����к��е�������ĿΪ___��д��2����SCN-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ___��
��3������ͭ�����백ˮ����������ⶼ���ܷ�Ӧ�������백ˮ��������Ļ����Һ��Ӧ����ԭ����___����Ӧ�Ļ�ѧ����ʽΪ___��
��4����Cu(H2O)4SO4��H2O�����У�[Cu(NH3)4]2+Ϊƽ�������νṹ�������������ṹ��ԭ������___��������ԭ�ӵ��ӻ����������___��
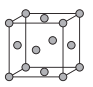
��5����֪Cu�ľ����ṹ��ͼ��ʾ��ͭԭ�ӵ���λ��Ϊ___����֪�����߳�Ϊ3.61��10-8cm����Cu���ܶ�Ϊ___ (������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MgCO3��CaCO3��������ϵ��ͼ��ʾ(M��Ca��Mg)��
����M2+(g)��CO32-(g)��![]() ��M2+(g)��O2(g)��CO2(g)
��M2+(g)��O2(g)��CO2(g)
![]() ������
������![]() ����
����![]()
��֪�����ӵ����ͬʱ���뾶ԽС�����Ӽ�Խǿ������˵������ȷ����
A. ��H1(MgCO3)����H1(CaCO3)��0
B. ��H2(MgCO3)����H2(CaCO3)��0
C. ��H1(CaCO3)����H1(MgCO3)����H3(CaO)����H3(MgO)
D. ����MgCO3��CaCO3����H1����H2����H3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com