
【题目】铅蓄电池的充放电反应为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
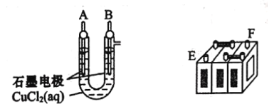
(1)将A接E、B接F,B电极出现_____________现象,电极反应式为_____________,说明F为正极。
(2)铅蓄电池工作时(放电),E电极的反应式为_____________,充电时该极与外接电源的_____________极相连。
(3)若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是______mol。
(4)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。
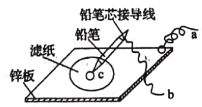
①若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现____色,铅笔芯c点处的电极反应式为________________。
②若用KI-淀粉溶液浸湿滤纸,用导线将a、b与铅蓄电池的E、F电极相连,铅笔芯c点处出现蓝色,则b接的是_______(填“E”或“F”)电极。
【答案】有气泡产生 2Cl--2e- = Cl2↑ Pb(s) - 2e-+ SO42- = PbSO4 负 0.1 红 O2 + 4e-+ 2H2O = 4OH- F
【解析】
(1)F要证明是正极,说明B为阳极。
(2)铅蓄电池工作时(放电),E电极为负极,充电时该极与外接电源的负极相连。
(3)根据方程式分析,1mol PbO2反应转移2mol电子。
(4)①导线将a、b直接相连,则锌板为负极,铅笔为正极,氧气反应生成氢氧根;②若用KI-淀粉溶液浸湿滤纸,铅笔芯c点处出现蓝色,说明c点生成了单质碘,则c为阳极。
(1)F要证明是正极,说明B为阳极,阳极应该阴离子氯离子放电变为氯气,因此B电极出现有气泡产生现象,电极反应式为2Cl--2e- = Cl2↑;故答案为:有气泡产生;2Cl--2e- = Cl2↑。
(2)铅蓄电池工作时(放电),E电极为负极,其负极反应式为Pb(s) - 2e-+ SO42- = PbSO4,充电时该极与外接电源的负极相连;故答案为:Pb(s) - 2e-+ SO42- = PbSO4;负。
(3)根据Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1),1mol PbO2反应转移2mol电子,若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是0.1 mol;故答案为:0.1。
2PbSO4(s)+2H2O(1),1mol PbO2反应转移2mol电子,若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是0.1 mol;故答案为:0.1。
(4)①若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则锌板为负极,铅笔为正极,氧气反应生成氢氧根,氢氧根使酚酞变红,因此滤纸出现红色,铅笔芯c点处的电极反应式为O2 + 4e-+ 2H2O = 4OH-;故答案为:红;O2 + 4e-+ 2H2O = 4OH-。
②若用KI-淀粉溶液浸湿滤纸,铅笔芯c点处出现蓝色,说明c点生成了单质碘,则c为阳极,连接电源正极,则b接的是正极即F电极;故答案为:F。


科目:高中化学 来源: 题型:
【题目】用盐酸标准液来滴定NaOH待测液,下列操作可能会使测定结果偏低的是
A. 酸式滴定管只用水洗
B. 锥形瓶只用水洗
C. 使用甲基橙做指示剂
D. 第一次观察酸式滴定管的刻度时仰视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究发现,高度对称的有机分子具有致密性高、稳定性强、张力能大等特点。饱和烃中有一系列高度对称结构的烃,如![]() (正四面体烷C4H4)、
(正四面体烷C4H4)、![]() (棱晶烷C6H6)、
(棱晶烷C6H6)、![]() (立方烷C8H8),下列有关说法正确的是
(立方烷C8H8),下列有关说法正确的是
A.上述三种物质中的C原子都形成4个单键,因此它们都属于烷烃
B.上述三种物质互为同系物,它们的通式为C2nH2n(n≥2)
C.棱晶烷与立方烷中碳原子均为饱和碳原子,其二氯代物的数目不同
D.棱晶烷与立方烷在光照条件下均可与氯气发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是最常使用的稀土磁铁,被广泛应用于电子产品中。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其他物质。请回答下列问题:
(1)钕(Nd)为60号元素,在元素周期表中位于第____周期;基态Fe2+外围电子的轨道表达式为_____________。
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。

①该分子中Al原子采取______杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学键有____(填标号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.氢键
(3)FeO是离子晶体,其晶格能可通过如下的Born﹣Haber循环计算得到。

基态Fe原子的第一电离能为___kJ·mol-1,FeO的晶格能为___kJ·mol-1。
(4)因材料中含有大量的钕和铁,容易锈蚀是钕铁硼磁铁的一大弱点,可通过电镀镍(Ni)等进行表面涂层处理。已知Ni可以形成化合物四羰基镍[Ni(CO)4],其为无色易挥发剧毒液体,熔点为-25 ℃,沸点为43 ℃,不溶于水,易溶于乙醇、苯、四氯化碳等有机溶剂,四羰基镍的晶体类型是_______,写出与配体互为等电子体的分子和离子的化学式为_____、_____(各写一种)。
(5)已知立方BN晶体硬度很大,其原因是________;其晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为a nm,阿伏加德罗常数的值为NA,则晶体的密度为_____g·cm-3(列式即可,用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. △H>0的化学反应一定不能自发进行
B. 反应2NO2(g)![]() N2O4(l)的熵(体系的混乱度)增大(即△S>0)
N2O4(l)的熵(体系的混乱度)增大(即△S>0)
C. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )
A. 加催化剂B. 充入CO增大压强C. 充入N2D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液分别滴定体积均为20mL,浓度均为0.1mol/LHCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图。下列说法正确的是
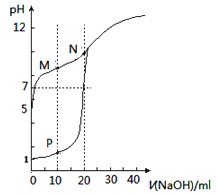
A. M点c(HX)-c(X-)>c(OH-)-c(H+)
B. N点的pH>7的原因是由于NaOH过量所致
C. HX为弱酸,且电离平衡常数Ka≈1×10-10
D. P点c(Cl-)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
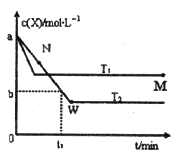
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0t1时间内,υ(Y)=![]()
C.M点的平衡常数比W点的平衡常数小
D.M点时再加入一定量的X,平衡后X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究,其反应原为:3Fe+4H2O(g)![]() Fe3O4+4H2,Fe3O4+8HCl(浓)
Fe3O4+4H2,Fe3O4+8HCl(浓)![]() FeCl2+2FeCl3+4H2O。
FeCl2+2FeCl3+4H2O。
根据如图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。

试回答下列问题:
(1)实验中使用肥皂液检验的产物是___;图中湿棉花的作用是___;
(2)甲组同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:
实验序号 | 实验操作 | 实验现象 |
① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中滴加几滴KSCN溶液,充分振荡 | 溶液没有出现血红色 |
根据上述实验,他们不能完全确定残留固体的成分,但肯定能确定残留黑色固体中含有的一种物质是___;
(3)乙组同学也进行了下列实验探究以证明实验后试管内残留黑色固体是否存在Fe3O4。
实验序号 | 实验操作 | 实验现象 |
① | 称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中加入足量的氯水,充分振荡 | 溶液呈黄色 |
③ | 向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量 | 得到21.4g红褐色固体 |
请根据乙组同学的实验操作和现象,你认为残留黑色固体中一定___(填“存在”或“不存在”)Fe3O4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com