
【题目】某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究,其反应原为:3Fe+4H2O(g)![]() Fe3O4+4H2,Fe3O4+8HCl(浓)
Fe3O4+4H2,Fe3O4+8HCl(浓)![]() FeCl2+2FeCl3+4H2O。
FeCl2+2FeCl3+4H2O。
根据如图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。

试回答下列问题:
(1)实验中使用肥皂液检验的产物是___;图中湿棉花的作用是___;
(2)甲组同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:
实验序号 | 实验操作 | 实验现象 |
① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中滴加几滴KSCN溶液,充分振荡 | 溶液没有出现血红色 |
根据上述实验,他们不能完全确定残留固体的成分,但肯定能确定残留黑色固体中含有的一种物质是___;
(3)乙组同学也进行了下列实验探究以证明实验后试管内残留黑色固体是否存在Fe3O4。
实验序号 | 实验操作 | 实验现象 |
① | 称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中加入足量的氯水,充分振荡 | 溶液呈黄色 |
③ | 向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量 | 得到21.4g红褐色固体 |
请根据乙组同学的实验操作和现象,你认为残留黑色固体中一定___(填“存在”或“不存在”)Fe3O4。
【答案】氢气或H2 提供水蒸气 铁或Fe 存在
【解析】
(1)该反应进行产生氢气,反应的原料需要水蒸气;
(2)铁与盐酸反应有气泡冒出;
(3)残留黑色固体,假设全是铁,进过系列反应,生成的21.4g红褐色固体为Fe(OH)3,根据守恒法计算,如果相等,证明只有铁,如果不相等,则有Fe3O4。
(1)使用肥皂液的作用是收集并检验反应中生成的H2,故答案为氢气或H2;反应的原料需要水蒸气,湿棉花可提供水,故答案为:提供水蒸气;
(2)加入足量浓盐酸,黑色粉末逐渐溶解,溶液呈绿色,有少量气泡产生,说明一定有单质铁,故答案为铁或Fe;
(3)Fe~ Fe(OH)3,根据守恒法计算,生成的21.4g红褐色固体为Fe(OH)3,需要铁的质量=![]() =11.2g,而实际上称取14.4g残留黑色固体,故存在Fe3O4,故答案为存在。
=11.2g,而实际上称取14.4g残留黑色固体,故存在Fe3O4,故答案为存在。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】铅蓄电池的充放电反应为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
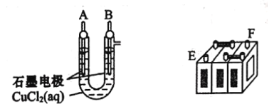
(1)将A接E、B接F,B电极出现_____________现象,电极反应式为_____________,说明F为正极。
(2)铅蓄电池工作时(放电),E电极的反应式为_____________,充电时该极与外接电源的_____________极相连。
(3)若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是______mol。
(4)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。
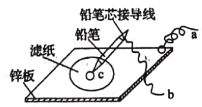
①若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现____色,铅笔芯c点处的电极反应式为________________。
②若用KI-淀粉溶液浸湿滤纸,用导线将a、b与铅蓄电池的E、F电极相连,铅笔芯c点处出现蓝色,则b接的是_______(填“E”或“F”)电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贝诺酯是一种解热镇痛药,在酶的作用下可以释放出阿司匹林和扑热息痛,其结构为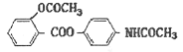 ,其合成途径如下:
,其合成途径如下:
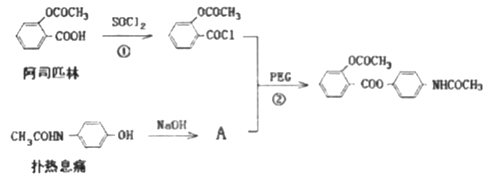
完成下列填空:
(1)反应①的反应类型为________________,有机物A与扑热息痛的式量相差______________
(2)贝诺酯所含的含氧官能团是__________
(3)写出反应②的化学方程式_____________
(4)关于阿司匹林性质叙述正确的是(填选项编号)____________
A.能与氯化铁溶液发生显色反应 B.能与氢氧化铜悬浊液反应
C.能发生消去反应 D.能发生酯化反应
(5)符合下列条件的扑热息痛的同系物共有_________种,写出其中一种的结构简式___________。
①碳原子数比扑热息痛多2个 ②苯环上只有2个对位的支链 ③含有2个甲基
(6)若已知:
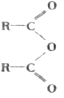 +R'OH
+R'OH![]() RCOOH +RCOOR'
RCOOH +RCOOR'
现以苯酚和乙酸酐(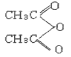 )为有机原料,合成阿司匹林,请设计完成下列合成途径______(合成路线常用的表示方法为:A
)为有机原料,合成阿司匹林,请设计完成下列合成途径______(合成路线常用的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
硫酸的工业用途非常广泛,可用于制造化肥、除铁锈、作电解液等。工业制硫酸的关键一步是将SO2氧化为SO3,该反应为2SO2+O2![]() 2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
【1】SO2与O2在一定条件下反应生成SO3,该反应属于( )
A.化合反应B.分解反应C.置换反应D.复分解反应
【2】上述材料中的反应是氧化还原反应,下列有关该反应的说法正确的是( )
A.O2是还原剂B.SO2被氧化
C.O2失去电子D.SO2发生还原反应
【3】上述材料中的反应在密闭容器中进行,下列关于该反应的说法正确的是( )
A.升高温度能减慢反应速率
B.SO2与O2能100%转化为SO3
C.减小O2的浓度能加快反应速率
D.使用恰当的催化剂能加快反应速率
【4】上述材料中的反应为放热反应,下列说法正确的是( )
A.断开化学键放出能量
B.放热反应都不需要加热
C.该反应的逆反应是吸热反应
D.该反应的反应物总能量小于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 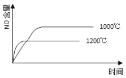
B. 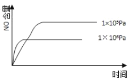
C. 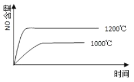
D. 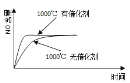
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。X、Y、Z、W最外层电子数之和为16,Y 原子的最外层电子数是其内层电子数的3倍,Z2+ 与Y2- 具有相同的电子层结构,W 与X 同主族。下列说法正确的是
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、X形成的化合物中化学键类型相同
C.X的最高价氧化物对应的水化物是一种强酸
D.Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
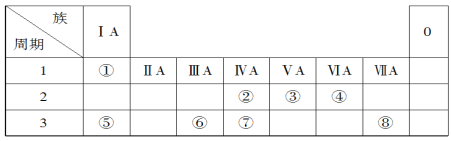
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
除稀有气体外,原子半径最大的元素是______,它的原子结构示意图是________。
(2)②的最高价氧化物的分子式为________;
⑦的最高价氧化物对应水化物的分子式为________;
最高价氧化物对应的水化物中酸性最强的是________。
(3)①④⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:________________________________。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是________。
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b与a所有可能的关系式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com