
ЁОЬтФПЁПЧыдФЖСЯТСаВФСЯЃЌЭъГЩЯТУцаЁЬтЁЃ
СђЫсЕФЙЄвЕгУЭОЗЧГЃЙуЗКЃЌПЩгУгкжЦдьЛЏЗЪЁЂГ§ЬњатЁЂзїЕчНтвКЕШЁЃЙЄвЕжЦСђЫсЕФЙиМќвЛВНЪЧНЋSO2бѕЛЏЮЊSO3ЃЌИУЗДгІЮЊ2SO2ЃЋO2![]() 2SO3ЁЃЕЋИУЗДгІЫйТЪаЁЃЌЮоЗЈЭЖШыЙЄвЕЛЏЩњВњЁЃКѓРДЛЏбЇМвУЧВЛЖЯЕиИФНјЗДгІЬѕМўЃЌевЕНСЫРэЯыЕФДпЛЏМСМАЗДгІЕФЪЪвЫЮТЖШЃЌГЩЙІПЊЗЂГіСЫжЦдьСђЫсЕФЩњВњЙЄвеЁЃ
2SO3ЁЃЕЋИУЗДгІЫйТЪаЁЃЌЮоЗЈЭЖШыЙЄвЕЛЏЩњВњЁЃКѓРДЛЏбЇМвУЧВЛЖЯЕиИФНјЗДгІЬѕМўЃЌевЕНСЫРэЯыЕФДпЛЏМСМАЗДгІЕФЪЪвЫЮТЖШЃЌГЩЙІПЊЗЂГіСЫжЦдьСђЫсЕФЩњВњЙЄвеЁЃ
ЁО1ЁПSO2гыO2дквЛЖЈЬѕМўЯТЗДгІЩњГЩSO3ЃЌИУЗДгІЪєгкЃЈ ЃЉ
A.ЛЏКЯЗДгІB.ЗжНтЗДгІC.жУЛЛЗДгІD.ИДЗжНтЗДгІ
ЁО2ЁПЩЯЪіВФСЯжаЕФЗДгІЪЧбѕЛЏЛЙдЗДгІЃЌЯТСагаЙиИУЗДгІЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.O2ЪЧЛЙдМСB.SO2БЛбѕЛЏ
C.O2ЪЇШЅЕчзгD.SO2ЗЂЩњЛЙдЗДгІ
ЁО3ЁПЩЯЪіВФСЯжаЕФЗДгІдкУмБеШнЦїжаНјааЃЌЯТСаЙигкИУЗДгІЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.Щ§ИпЮТЖШФмМѕТ§ЗДгІЫйТЪ
B.SO2гыO2Фм100%зЊЛЏЮЊSO3
C.МѕаЁO2ЕФХЈЖШФмМгПьЗДгІЫйТЪ
D.ЪЙгУЧЁЕБЕФДпЛЏМСФмМгПьЗДгІЫйТЪ
ЁО4ЁПЩЯЪіВФСЯжаЕФЗДгІЮЊЗХШШЗДгІЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ЖЯПЊЛЏбЇМќЗХГіФмСП
B.ЗХШШЗДгІЖМВЛашвЊМгШШ
C.ИУЗДгІЕФФцЗДгІЪЧЮќШШЗДгІ
D.ИУЗДгІЕФЗДгІЮязмФмСПаЁгкЩњГЩЮяЕФзмФмСП
ЁОД№АИЁП
ЁО1ЁПA
ЁО2ЁПB
ЁО3ЁПD
ЁО4ЁПC
ЁОНтЮіЁП
ЁО1ЁП2SO2ЃЋO2![]() 2SO3ЃЌИУЗДгІЪєгкЛЏКЯЗДгІЃЌЙЪAе§ШЗЁЃ
2SO3ЃЌИУЗДгІЪєгкЛЏКЯЗДгІЃЌЙЪAе§ШЗЁЃ
злЩЯЫљЪіЃЌД№АИЮЊAЁЃ
ЁО2ЁП2SO2ЃЋO2![]() 2SO3ЪЧбѕЛЏЛЙдЗДгІЃЌSO2ЛЏКЯМлЩ§ИпЃЌЗЂЩњбѕЛЏЗДгІЃЌБЛбѕЛЏЃЌЛЏКЯМлНЕЕЭЃЌЗЂЩњЛЙдЗДгІЃЌБЛЛЙдЃЌЙЪBе§ШЗЁЃ
2SO3ЪЧбѕЛЏЛЙдЗДгІЃЌSO2ЛЏКЯМлЩ§ИпЃЌЗЂЩњбѕЛЏЗДгІЃЌБЛбѕЛЏЃЌЛЏКЯМлНЕЕЭЃЌЗЂЩњЛЙдЗДгІЃЌБЛЛЙдЃЌЙЪBе§ШЗЁЃ
злЩЯЫљЪіЃЌД№АИЮЊBЁЃ
ЁО3ЁПA. Щ§ИпЮТЖШФмМгПьЗДгІЫйТЪЃЌЙЪAДэЮѓЃЛ
B. 2SO2ЃЋO2![]() 2SO3ЪЧПЩФцЗДгІЃЌвђДЫSO2гыO2ВЛПЩФм100%зЊЛЏЮЊSO3ЃЌЙЪBДэЮѓЃЛ
2SO3ЪЧПЩФцЗДгІЃЌвђДЫSO2гыO2ВЛПЩФм100%зЊЛЏЮЊSO3ЃЌЙЪBДэЮѓЃЛ
C. МѕаЁO2ЕФХЈЖШЛсНЕЕЭЗДгІЫйТЪЃЌЙЪCДэЮѓЃЛ
D. ЪЙгУЧЁЕБЕФДпЛЏМСФмМгПьЗДгІЫйТЪЃЌЙЪDе§ШЗЁЃ
злЩЯЫљЪіЃЌД№АИЮЊDЁЃ
ЁО4ЁПA. ЖЯПЊЛЏбЇМќЮќЪеФмСПЃЌЙЪAДэЮѓЃЛ
B. ЗХШШЗДгІвВПЩФмашвЊМгШШЃЌБШШчЬМШМЩеашвЊМгШШЃЌЙЪBДэЮѓЃЛ
C. ИУЗДгІЕФФцЗДгІЪЧЮќШШЗДгІЃЌЙЪCе§ШЗЃЛ
D. ИУЗДгІЕФЗДгІЮязмФмСПДѓгкЩњГЩЮяЕФзмФмСПЃЌЙЪDДэЮѓЁЃ
злЩЯЫљЪіЃЌД№АИЮЊCЁЃ


 ХргХПкЫуЬтПЈЯЕСаД№АИ
ХргХПкЫуЬтПЈЯЕСаД№АИ ПЊаФПкЫуЬтПЈЯЕСаД№АИ
ПЊаФПкЫуЬтПЈЯЕСаД№АИ ПкЫуЬтПЈКгББЩйФъЖљЭЏГіАцЩчЯЕСаД№АИ
ПкЫуЬтПЈКгББЩйФъЖљЭЏГіАцЩчЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкКуШнУмБеШнЦїжаЃЌНјааШчЯТЗДгІЃКNO(g)+CO(g)![]()
![]() N2(g)+CO2(g)ЃЛЁїH=Љ373.2kJ/molДяЕНЦНКтКѓЃЌЮЊЬсИпNOЕФзЊЛЏТЪЃЌВЩШЁЕФе§ШЗДыЪЉЪЧ( )
N2(g)+CO2(g)ЃЛЁїH=Љ373.2kJ/molДяЕНЦНКтКѓЃЌЮЊЬсИпNOЕФзЊЛЏТЪЃЌВЩШЁЕФе§ШЗДыЪЉЪЧ( )
A. МгДпЛЏМСB. ГфШыCOдіДѓбЙЧПC. ГфШыN2D. Щ§ИпЮТЖШ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙўВЎвђЗЂУїСЫгЩЕЊЦјКЭЧтЦјКЯГЩАБЦјЕФЗНЗЈЖјЛёЕУ1918ФъХЕБДЖћЛЏбЇНБЁЃЯжЯђвЛУмБеШнЦїжаГфШы1mol N2КЭ3mol H2ЃЌдквЛЖЈЬѕМўЯТЪЙИУЗДгІЗЂЩњЃКN2ЃЋ3H2![]() 2NH3ЁЃЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
2NH3ЁЃЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. ДяЕНЛЏбЇЦНКтЪБЃЌе§ЗДгІКЭФцЗДгІЕФЫйТЪЖМЮЊСу
B. ЕБЗћКЯЃК3е§N2ЃНе§H2ЪБЃЌЗДгІДяЕНЦНКтзДЬЌ
C. ДяЕНЛЏбЇЦНКтЪБЃЌЕЅЮЛЪБМфЯћКФa molN2ЃЌЭЌЪБЩњГЩ3a molH2
D. ЕБN2ЁЂH2ЁЂNH3ЕФЗжзгЪ§БШЮЊ1ЁУ3ЁУ2ЃЌЗДгІДяЕНЦНКтзДЬЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУЫсЪНЕЮЖЈЙмзМШЗвЦШЁ 25.00mL ФГЮДжЊХЈЖШЕФбЮЫсгквЛНрОЛЕФзЖаЮЦПжаЃЌШЛКѓгУ0.2000molLЉ1 ЕФЧтбѕЛЏФЦШмвКЕЮЖЈ(жИЪОМСЮЊЗгЬЊ)ЃЌЕЮЖЈНсЙћШчЯТЃК
NaOH Ц№ЪМЖСЪ§ | NaOH жеЕуЖСЪ§ | |
ЕквЛДЮ | 0.10mL | 18.60mL |
ЕкЖўДЮ | 0.30mL | 19.30mL |
ЕкШ§ДЮ | 0.50mL | 16.30mL |
(1)ИљОнвдЩЯЪ§ОнПЩвдМЦЫуГібЮЫсЕФЮяжЪЕФСПХЈЖШЮЊ________molLЉ1ЁЃ
(2)ЫсЪНЕЮЖЈЙмЪЙгУЕФЕквЛВНВйзїЪЧ________
(3)вдЯТВйзїдьГЩВтЖЈНсЙћЦЋИпЕФдвђПЩФмЪЧ________ЁЃ
A.еёЕДзЖаЮЦПЪБгавКЕЮНІГі
B.ЕЮЖЈжеЕуЖСЪ§ЪБЃЌИЉЪгЕЮЖЈЙмЕФПЬЖШЃЌЦфЫќВйзїОље§ШЗ
C.ЪЂзАЮДжЊвКЕФзЖаЮЦПгУеєСѓЫЎЯДЙ§ЃЌЮДгУД§ВтвКШѓЯД
D.ЕЮЖЈЕНжеЕуЖСЪ§ЪБЗЂЯжЕЮЖЈЙмМтзьДІаќЙввЛЕЮШмвК
E.ЮДгУБъзМвКШѓЯДМюЪНЕЮЖЈЙм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГбаОПадбЇЯАаЁзщЖдЛЙдЬњЗлгыЫЎеєЦјЕФЗДгІМАВњЮяНјааПЦбЇЬНОПЃЌЦфЗДгІдЮЊЃК3Fe+4H2O(g)![]() Fe3O4+4H2ЃЌFe3O4+8HCl(ХЈ)
Fe3O4+4H2ЃЌFe3O4+8HCl(ХЈ)![]() FeCl2+2FeCl3+4H2OЁЃ
FeCl2+2FeCl3+4H2OЁЃ
ИљОнШчЭМЫљЪОЪЕбщзАжУЃЌЭЌбЇУЧНјааСЫЛЙдЬњЗлгыЫЎеєЦјЗДгІЕФЪЕбщЁЃ

ЪдЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЪЕбщжаЪЙгУЗЪдэвКМьбщЕФВњЮяЪЧ___ЃЛЭМжаЪЊУоЛЈЕФзїгУЪЧ___ЃЛ
ЃЈ2ЃЉМззщЭЌбЇЮЊСЫНјвЛВНШЗЖЈЗДгІЪЧЗёЗЂЩњЃЌЖдЪЕбщКѓЪдЙмФкВаСєКкЩЋЙЬЬхЕФГЩЗжНјааСЫЯТСаЪЕбщЬНОПЃК
ЪЕбщађКХ | ЪЕбщВйзї | ЪЕбщЯжЯѓ |
Ђй | ШЁЩйСПВаСєКкЩЋЙЬЬхЗХШыЩеБжаЃЌМгШызуСПХЈбЮЫсЃЌЮЂШШ | КкЩЋЙЬЬхж№НЅШмНтЃЌгаЦјХнВњЩњЃЌШмвКГЪЧГТЬЩЋЁЃ |
Ђк | ЯђЩЯЪіЩеБжаЕЮМгМИЕЮKSCNШмвКЃЌГфЗжеёЕД | ШмвКУЛгаГіЯжбЊКьЩЋ |
ИљОнЩЯЪіЪЕбщЃЌЫћУЧВЛФмЭъШЋШЗЖЈВаСєЙЬЬхЕФГЩЗжЃЌЕЋПЯЖЈФмШЗЖЈВаСєКкЩЋЙЬЬхжаКЌгаЕФвЛжжЮяжЪЪЧ___ЃЛ
ЃЈ3ЃЉввзщЭЌбЇвВНјааСЫЯТСаЪЕбщЬНОПвджЄУїЪЕбщКѓЪдЙмФкВаСєКкЩЋЙЬЬхЪЧЗёДцдкFe3O4ЁЃ
ЪЕбщађКХ | ЪЕбщВйзї | ЪЕбщЯжЯѓ |
Ђй | ГЦШЁ14.4gВаСєКкЩЋЙЬЬхЗХШыЩеБжаЃЌМгШызуСПХЈбЮЫсЃЌЮЂШШ | КкЩЋЙЬЬхж№НЅШмНтЃЌгаЦјХнВњЩњЃЌШмвКГЪЧГТЬЩЋЁЃ |
Ђк | ЯђЩЯЪіЩеБжаМгШызуСПЕФТШЫЎЃЌГфЗжеёЕД | ШмвКГЪЛЦЩЋ |
Ђл | ЯђЩЯЪіЩеБжаМгШызуСПNaOHШмвКЃЌЙ§ТЫЁЂЯДЕгЁЂИЩдяЁЂГЦСП | ЕУЕН21.4gКьКжЩЋЙЬЬх |
ЧыИљОнввзщЭЌбЇЕФЪЕбщВйзїКЭЯжЯѓЃЌФуШЯЮЊВаСєКкЩЋЙЬЬхжавЛЖЈ___(ЬюЁАДцдкЁБЛђЁАВЛДцдкЁБ)Fe3O4ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЁЂ101kPaЯТЃЌЬМЁЂЧтЦјЁЂМзЭщКЭЦЯЬбЬЧЕФШМЩеШШвРДЮЪЧ393.5kJ/molЁЂ285.8kJ/molЁЂ890.3kJ/molЁЂ2800kJ/molЃЌдђЯТСаШШЛЏбЇЗНГЬЪНе§ШЗЕФЪЧ
A.CЃЈsЃЉ+![]() O2ЃЈgЃЉЃНCOЃЈgЃЉ ІЄH=-393.5kJ/mol
O2ЃЈgЃЉЃНCOЃЈgЃЉ ІЄH=-393.5kJ/mol
B.2H2ЃЈgЃЉ+O2ЃЈgЃЉЃН2H2OЃЈlЃЉ ІЄH =+571.6kJ/mol
C.CH4ЃЈgЃЉ+2O2ЃЈgЃЉЃН CO2ЃЈgЃЉ+2H2OЃЈgЃЉ ІЄH=-890.3kJ/mol
D.C6H12O6ЃЈsЃЉ+6O2ЃЈgЃЉЃН6CO2ЃЈgЃЉ+6H2OЃЈlЃЉ ІЄH=-2800kJ/mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПMgSO4ЁЄ7H2OЪЧвЛжжживЊЕФЛЏЙЄдСЯЃЌФГбаОПадбЇЯАаЁзщЩшМЦСЫРћгУСтУОПѓЪЏ(жївЊГЩЗжЪЧMgCO3ЃЌВЂКЌгаMnCO3ЁЂSiO2)жЦШЁMgSO4ЁЄ7H2OЕФЪЕбщСїГЬШчЯТЃК
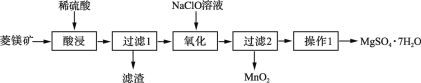
(1)Й§ТЫ1ЕФТЫдќжївЊГЩЗжЪЧ____ЁЃ
(2)бѕЛЏЪБЗЂЩњЗДгІЕФРызгЗДгІЗНГЬЪНЮЊ________________ЁЃ
(3)Вйзї1вЊОЙ§____ЁЂ____ЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЕШВНжшВХПЩЕУЕНВњЦЗЁЃ
(4)ФГMgSO4ЁЄ7H2OВњЦЗжаЛьгаЩйСПCaSO4ЁЂAl2(SO4)3ЁЂFe2(SO4)3ЃЌПЩЭЈЙ§ЯТСаЗНЗЈВтЖЈЦфДПЖШ:
Ђё.ГЦШЁД§ВтбљЦЗ10.00 gЃЌМгЫЎШмНтХфГЩ 250 mLШмвКAД§гУЁЃ
Ђђ.ШЁ10 .00 mLШмвКAЃЌМгШыШ§ввДМАЗШмвКЃЌМгШыЩйаэАБЫЎЕїНкpHжС7~8ЃЌдйгУ0.02 molЁЄL-1 EDTA(H2Y2-)гыжЎГфЗжЗДгІЃЌЙВгУШЅEDTAШмвК84.00 mLЁЃ
Ђѓ.ШЁ25.00 mLШмвКAЃЌМгШыШ§ввДМАЗШмвКЃЌдйМгШы0.125 molЁЄL-1 NaOHШмвКЕїНкpHжС12~13ЃЌгУ0.02 molЁЄL-1 EDTAгыжЎГфЗжЗДгІЃЌЙВгУШЅEDTAШмвК10.00 mLЁЃ
вбжЊ:
Ђй Mg2+дкpH=9.1ЪБПЊЪМГСЕэЃЌpH=12.1ЪБГСЕэЭъШЋЃЛCa2+дкpH=13.1ЪБЛЙЮДГСЕэЁЃ
Ђк Mg2++H2Y2-=MgH2YЁЂCa2++H2Y2-=CaH2YЁЃ
Ђл дкШ§ввДМАЗЕФзїгУЯТЦфЫћдгжЪВЛгыEDTAЗДгІЁЃ
МЦЫубљЦЗжаMgSO4ЁЄ7H2OЕФжЪСПЗжЪ§__________(аДГіМЦЫуЙ§ГЬ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩсРеЗЂЯжТШЦјЪЧдк1774ФъЃЌЕБЪБЫће§дкбаОПШэУЬПѓ(ЖўбѕЛЏУЬ)ЃЌЕБЫћЪЙШэУЬПѓгыХЈбЮЫсЛьКЯВЂМгШШЪБЃЌВњЩњСЫвЛжжЛЦТЬЩЋЕФЦјЬхЃЌЗЂЩњЗДгІЕФЗНГЬЪНЮЊMnO2+4HCl(ХЈ)![]() MnCl2+Cl2Ёќ+2H2OЃЌетжжЦјЬхЕФЧПСвЕФДЬМЄадЦјЮЖЪЙЩсРеИаЕНМЋЮЊФбЪмЃЌЕЋЪЧЕБЫћШЗаХздМКжЦЕУСЫвЛжжаТЦјЬхКѓЃЌЫћгжИаЕНвЛжжгЩждЕФПьРжЁЃЩсРежЦБИГіТШЦјвдКѓЃЌАбЫќШмНтдкЫЎРяЃЌЗЂЯжетжжЫЎШмвКЖджНеХЁЂЪпВЫКЭЛЈЖМОпгагРОУадЕФЦЏАззїгУЃЛЫћЛЙЗЂЯжТШЦјФмгыН№ЪєЁЂЗЧН№ЪєЁЂМюЕШЗЂЩњЛЏбЇЗДгІЁЃ
MnCl2+Cl2Ёќ+2H2OЃЌетжжЦјЬхЕФЧПСвЕФДЬМЄадЦјЮЖЪЙЩсРеИаЕНМЋЮЊФбЪмЃЌЕЋЪЧЕБЫћШЗаХздМКжЦЕУСЫвЛжжаТЦјЬхКѓЃЌЫћгжИаЕНвЛжжгЩждЕФПьРжЁЃЩсРежЦБИГіТШЦјвдКѓЃЌАбЫќШмНтдкЫЎРяЃЌЗЂЯжетжжЫЎШмвКЖджНеХЁЂЪпВЫКЭЛЈЖМОпгагРОУадЕФЦЏАззїгУЃЛЫћЛЙЗЂЯжТШЦјФмгыН№ЪєЁЂЗЧН№ЪєЁЂМюЕШЗЂЩњЛЏбЇЗДгІЁЃ
ЩсРеЗЂЯжТШЦјЪЧдк1774ФъЃЌЕБЪБЫће§дкбаОПШэУЬПѓ(ЖўбѕЛЏУЬ)ЃЌЕБЫћЪЙШэУЬПѓгыХЈбЮЫсЛьКЯВЂМгШШЪБЃЌВњЩњСЫвЛжжЛЦТЬЩЋЕФЦјЬхЃЌЗЂЩњЗДгІЕФЗНГЬЪНЮЊMnO2+4HCl(ХЈ)![]() MnCl2+Cl2Ёќ+2H2OЃЌетжжЦјЬхЕФЧПСвЕФДЬМЄадЦјЮЖЪЙЩсРеИаЕНМЋЮЊФбЪмЃЌЕЋЪЧЕБЫћШЗаХздМКжЦЕУСЫвЛжжаТЦјЬхКѓЃЌЫћгжИаЕНвЛжжгЩждЕФПьРжЁЃЩсРежЦБИГіТШЦјвдКѓЃЌАбЫќШмНтдкЫЎРяЃЌЗЂЯжетжжЫЎШмвКЖджНеХЁЂЪпВЫКЭЛЈЖМОпгагРОУадЕФЦЏАззїгУЃЛЫћЛЙЗЂЯжТШЦјФмгыН№ЪєЁЂЗЧН№ЪєЁЂМюЕШЗЂЩњЛЏбЇЗДгІЁЃ
MnCl2+Cl2Ёќ+2H2OЃЌетжжЦјЬхЕФЧПСвЕФДЬМЄадЦјЮЖЪЙЩсРеИаЕНМЋЮЊФбЪмЃЌЕЋЪЧЕБЫћШЗаХздМКжЦЕУСЫвЛжжаТЦјЬхКѓЃЌЫћгжИаЕНвЛжжгЩждЕФПьРжЁЃЩсРежЦБИГіТШЦјвдКѓЃЌАбЫќШмНтдкЫЎРяЃЌЗЂЯжетжжЫЎШмвКЖджНеХЁЂЪпВЫКЭЛЈЖМОпгагРОУадЕФЦЏАззїгУЃЛЫћЛЙЗЂЯжТШЦјФмгыН№ЪєЁЂЗЧН№ЪєЁЂМюЕШЗЂЩњЛЏбЇЗДгІЁЃ
(1)ТШЦјКЭЧтЦјЕФЗДгІЕФЪєгк____________
AЃЎЗжНтЗДгІ BЃЎЛЏКЯЗДгІ CЃЎжУЛЛЗДгІ DЃЎИДЗжНтЗДгІ
(2)ЖдгкЗДгІMnO2+4HCl(ХЈ)![]() MnCl2+Cl2Ёќ+2H2OЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ_____________
MnCl2+Cl2Ёќ+2H2OЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ_____________
AЃЎMnO2ЪЧЛЙдМСЁЁ BЃЎMnCl2ЪЧбѕЛЏВњЮяЁЁ
CЃЎCl2ЪЧбѕЛЏВњЮяЁЁ DЃЎH2OЪЧЛЙдВњЮя
(3)ЯТСаЗДгІЬѕМўЕФИФБфЖдЪЕбщЪвжЦБИТШЦјЫйТЪЕФгАЯье§ШЗЕФЪЧ_____________
AЃЎдіДѓбЮЫсЕФХЈЖШФмМгПьЗДгІЫйТЪ
BЃЎШєгУЯЁбЮЫсгыЖўбѕЛЏУЬЗДгІдђЗДгІЫйТЪНЯТ§
CЃЎЩ§ИпЮТЖШФмМѕТ§ЗДгІЫйТЪ
DЃЎдіМгMnO2ЕФжЪСППЩЯджјМгПьЗДгІЫйТЪ
(4)ЧтЦјдкТШЦјжаШМЩеЮЊЗХШШЗДгІЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ________________
AЃЎЖЯПЊClЁЊClМќЗХГіФмСП BЃЎаЮГЩHЁЊClМќЮќЪеФмСП
CЃЎШМЩеЖМЪЧЗХШШЗДгІ DЃЎЗДгІЮяЕФзмФмСПаЁгкЩњГЩЮяЕФзмФмСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЖдзАжУЕФУшЪіжае§ШЗЕФЪЧ
A.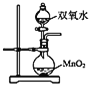 ЪЕбщЪвжаПЩгУМззАжУжЦШЁЩйСП O2
ЪЕбщЪвжаПЩгУМззАжУжЦШЁЩйСП O2
B.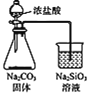 ПЩгУввзАжУБШНЯCЁЂSi ЕФЗЧН№Ъєад
ПЩгУввзАжУБШНЯCЁЂSi ЕФЗЧН№Ъєад
C.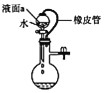 ШєБћзАжУЦјУмадСМКУЃЌдђвКУцaБЃГжЮШЖЈ
ШєБћзАжУЦјУмадСМКУЃЌдђвКУцaБЃГжЮШЖЈ
D.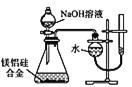 ПЩгУЖЁзАжУВтЖЈУОТСЙшКЯН№жа Mg ЕФКЌСП
ПЩгУЖЁзАжУВтЖЈУОТСЙшКЯН№жа Mg ЕФКЌСП
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com