
【题目】舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
(1)氯气和氢气的反应的属于____________
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)对于反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
A.MnO2是还原剂 B.MnCl2是氧化产物
C.Cl2是氧化产物 D.H2O是还原产物
(3)下列反应条件的改变对实验室制备氯气速率的影响正确的是_____________
A.增大盐酸的浓度能加快反应速率
B.若用稀盐酸与二氧化锰反应则反应速率较慢
C.升高温度能减慢反应速率
D.增加MnO2的质量可显著加快反应速率
(4)氢气在氯气中燃烧为放热反应,下列说法正确的是________________
A.断开Cl—Cl键放出能量 B.形成H—Cl键吸收能量
C.燃烧都是放热反应 D.反应物的总能量小于生成物的总能量
【答案】B C A C
【解析】
(1)从反应物和生成物的种类的多少,反应物和生成物的物质的类别分析;
(2)从化合价的变化分析;
(3)从化学反应速率的影响因素分析;
(4)反应放热,从化学键的角度分析;
(1)氯气和氢气在光照的条件下反应生成氯化氢,是两种物质生成一种物质的反应,属于化合反应,答案选B;
(2) A.Mn元素化合价降低被还原,MnO2为氧化剂,故A错误;
B.MnCl2还原产物,而不是氧化产物,故B错误;
C.Cl2是氧化产物,故C正确;
D.H2O既不是氧化产物,也不是还原产物,故D错误;
答案选C。
(3)A.增大盐酸的浓度能加快反应速率,故A正确;
B.稀盐酸与二氧化锰不反应,故B 错误;
C.升高温度能加快反应速率,故C错误;
D.MnO2为固体,增大MnO2的质量反应速率无明显变化,故D错误;
答案选A。
(4)A.断开化学键吸热,故A错误;
B.形成化学键放热,故B错误;
C.燃烧都是放热反应,故C正确;
D.反应物的总能量小于生成物的总能量为吸热反应,故D错误;
答案选C。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(s)+nB(g)eC(g)+fD(g),反应过程中,当其它条件不变时C 的百分含量与温度 (T)和压强(P)关系如图所示,下面叙述正确的是( )
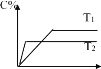
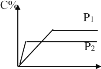
A.使用催化剂,C 的百分含量增大
B.升温,化学平衡向正反应方向移动
C.化学方程式的化学计量数关系 n<e+f
D.其他条件不变,增入 A 物质,提高 B 的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
硫酸的工业用途非常广泛,可用于制造化肥、除铁锈、作电解液等。工业制硫酸的关键一步是将SO2氧化为SO3,该反应为2SO2+O2![]() 2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
2SO3。但该反应速率小,无法投入工业化生产。后来化学家们不断地改进反应条件,找到了理想的催化剂及反应的适宜温度,成功开发出了制造硫酸的生产工艺。
【1】SO2与O2在一定条件下反应生成SO3,该反应属于( )
A.化合反应B.分解反应C.置换反应D.复分解反应
【2】上述材料中的反应是氧化还原反应,下列有关该反应的说法正确的是( )
A.O2是还原剂B.SO2被氧化
C.O2失去电子D.SO2发生还原反应
【3】上述材料中的反应在密闭容器中进行,下列关于该反应的说法正确的是( )
A.升高温度能减慢反应速率
B.SO2与O2能100%转化为SO3
C.减小O2的浓度能加快反应速率
D.使用恰当的催化剂能加快反应速率
【4】上述材料中的反应为放热反应,下列说法正确的是( )
A.断开化学键放出能量
B.放热反应都不需要加热
C.该反应的逆反应是吸热反应
D.该反应的反应物总能量小于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图所示装置模拟工业上生产无水FeCl2的过程。下列说法中正确的是( )
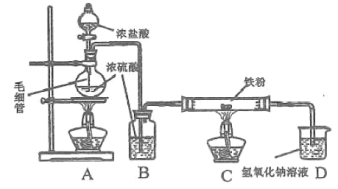
A.先点燃C处酒精灯,再打开分液漏斗的活塞
B.本实验中浓![]() 体现出吸水性和强氧化性
体现出吸水性和强氧化性
C.用D装置适合对该模拟实验进行尾气处理
D.C装置中的反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。X、Y、Z、W最外层电子数之和为16,Y 原子的最外层电子数是其内层电子数的3倍,Z2+ 与Y2- 具有相同的电子层结构,W 与X 同主族。下列说法正确的是
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、X形成的化合物中化学键类型相同
C.X的最高价氧化物对应的水化物是一种强酸
D.Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S。下列说法错误的是
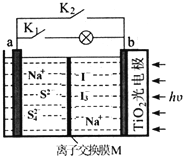
A. 充电时,太阳能转化为电能,又转化为化学能
B. 放电时,a极的电极反应式为:4S2--6e-=S42-
C. 充电时,阳极的电极反应式为:3I--2e-=I3-
D. M是阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
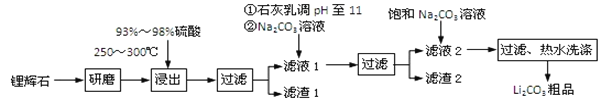
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是
A.淀粉![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B.纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,用下图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中。实验结果与预测的现象一致的是
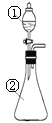
选项 | ①中的物质 | ②中的物质 | 预测②中的现象 |
A. | 氢氧化钠 | 明矾溶液 | 开始时即产生白色沉淀 |
B. | 浓硫酸 | 铜片 | 产生无色气体,溶液变蓝 |
C. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
D. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 开始时无明显现象 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com