
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。X、Y、Z、W最外层电子数之和为16,Y 原子的最外层电子数是其内层电子数的3倍,Z2+ 与Y2- 具有相同的电子层结构,W 与X 同主族。下列说法正确的是
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、X形成的化合物中化学键类型相同
C.X的最高价氧化物对应的水化物是一种强酸
D.Y的气态简单氢化物的热稳定性比W的强
【答案】D
【解析】
短周期主族元素X、Y、Z、W的原子序数依次增大,Y原子的最外层电子数是其内层电子数的3倍,则Y为O元素;Z2+与Y2-具有相同的电子层结构,可知Z为Mg元素;W与X同主族,最外层电子数相同,且X、Y、Z、W最外层电子数之和为16,则X的最外层电子数为![]() =4,则X为C,W为Si,以此来解答。
=4,则X为C,W为Si,以此来解答。
由上述分析可知,X为C,Y为O,Z为Mg,W为Si,
A.电子层越多原子半径越大,同周期从左向右原子半径减小,则原子半径的大小顺序:r(Z)>r(W)>r(X)>r(Y),故A错误;
B.Y分别与Z、W形成的化合物分别为MgO、SiO2,分别含离子键、共价键,故B错误;
C.X为C,X的最高价氧化物对应的水化物碳酸,碳酸是弱酸,故C错误;
D.非金属性Y>W,Y的气态简单氢化物的热稳定性比W的强,故D正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
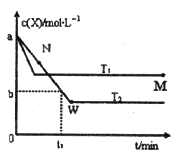
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0t1时间内,υ(Y)=![]()
C.M点的平衡常数比W点的平衡常数小
D.M点时再加入一定量的X,平衡后X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究,其反应原为:3Fe+4H2O(g)![]() Fe3O4+4H2,Fe3O4+8HCl(浓)
Fe3O4+4H2,Fe3O4+8HCl(浓)![]() FeCl2+2FeCl3+4H2O。
FeCl2+2FeCl3+4H2O。
根据如图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。

试回答下列问题:
(1)实验中使用肥皂液检验的产物是___;图中湿棉花的作用是___;
(2)甲组同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:
实验序号 | 实验操作 | 实验现象 |
① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中滴加几滴KSCN溶液,充分振荡 | 溶液没有出现血红色 |
根据上述实验,他们不能完全确定残留固体的成分,但肯定能确定残留黑色固体中含有的一种物质是___;
(3)乙组同学也进行了下列实验探究以证明实验后试管内残留黑色固体是否存在Fe3O4。
实验序号 | 实验操作 | 实验现象 |
① | 称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中加入足量的氯水,充分振荡 | 溶液呈黄色 |
③ | 向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量 | 得到21.4g红褐色固体 |
请根据乙组同学的实验操作和现象,你认为残留黑色固体中一定___(填“存在”或“不存在”)Fe3O4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgSO4·7H2O是一种重要的化工原料,某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3,并含有MnCO3、SiO2)制取MgSO4·7H2O的实验流程如下:
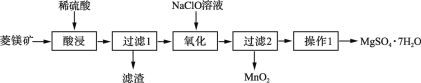
(1)过滤1的滤渣主要成分是____。
(2)氧化时发生反应的离子反应方程式为________________。
(3)操作1要经过____、____、过滤、洗涤、干燥等步骤才可得到产品。
(4)某MgSO4·7H2O产品中混有少量CaSO4、Al2(SO4)3、Fe2(SO4)3,可通过下列方法测定其纯度:
Ⅰ.称取待测样品10.00 g,加水溶解配成 250 mL溶液A待用。
Ⅱ.取10 .00 mL溶液A,加入三乙醇胺溶液,加入少许氨水调节pH至7~8,再用0.02 mol·L-1 EDTA(H2Y2-)与之充分反应,共用去EDTA溶液84.00 mL。
Ⅲ.取25.00 mL溶液A,加入三乙醇胺溶液,再加入0.125 mol·L-1 NaOH溶液调节pH至12~13,用0.02 mol·L-1 EDTA与之充分反应,共用去EDTA溶液10.00 mL。
已知:
① Mg2+在pH=9.1时开始沉淀,pH=12.1时沉淀完全;Ca2+在pH=13.1时还未沉淀。
② Mg2++H2Y2-=MgH2Y、Ca2++H2Y2-=CaH2Y。
③ 在三乙醇胺的作用下其他杂质不与EDTA反应。
计算样品中MgSO4·7H2O的质量分数__________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的说法正确的是( )
A.间二甲苯苯环上的一个氢原子被“![]() ”取代时,形成的同分异构体最多有6种
”取代时,形成的同分异构体最多有6种
B.将等物质的量的![]() 与
与![]() 混合,在光照条件下充分反应可以制得纯净的氯乙烷
混合,在光照条件下充分反应可以制得纯净的氯乙烷
C.苯与液溴混合后加入铁粉,此时苯发生了加成反应
D.食物中的纤维素在人体内可以水解生成葡萄糖,为人类活动提供能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种黄绿色的气体,发生反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
MnCl2+Cl2↑+2H2O,这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。舍勒制备出氯气以后,把它溶解在水里,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用;他还发现氯气能与金属、非金属、碱等发生化学反应。
(1)氯气和氢气的反应的属于____________
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)对于反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
MnCl2+Cl2↑+2H2O,下列说法正确的是_____________
A.MnO2是还原剂 B.MnCl2是氧化产物
C.Cl2是氧化产物 D.H2O是还原产物
(3)下列反应条件的改变对实验室制备氯气速率的影响正确的是_____________
A.增大盐酸的浓度能加快反应速率
B.若用稀盐酸与二氧化锰反应则反应速率较慢
C.升高温度能减慢反应速率
D.增加MnO2的质量可显著加快反应速率
(4)氢气在氯气中燃烧为放热反应,下列说法正确的是________________
A.断开Cl—Cl键放出能量 B.形成H—Cl键吸收能量
C.燃烧都是放热反应 D.反应物的总能量小于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种金属, B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟,生成NH4Cl。A、B、C、D、E、F间有如下变化关系:
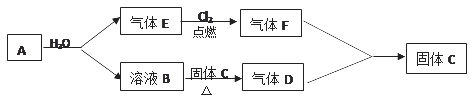
(1)A是________________;
(2)E在氯气中燃烧的实验现象是__________________;
(3)写出A→E、B反应的化学方程式:___________________;
(4)F在空气中遇水蒸气产生白雾现象,这白雾实际上是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与NO2+互为等电子体的分子________,根据等电子体原理,在NO2+中氮原子轨道杂化类型是________;O22+与N2互为等电子体,1mol O22+中含有的π键数目为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置不能完成相应实验的是
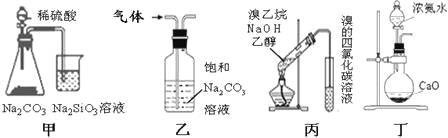
A.甲装置可比较硫、碳、硅三种元素的非金属性强弱
B.乙装置可除去CO2中少量的SO2杂质
C.丙装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯
D.丁装置可用于实验室制备氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com