
【题目】为探究某固体氧化物A(仅含两种元素)的组成和性质,设计并完成如下实验,。请回答:

(1)固体A的化学式______________。
(2)单质B在氯气中反应的现象_______________________________。
(3)写出C→D在溶液中发生氧化还原反应的离子方程式_______________________________。
【答案】Fe3O4 剧烈燃烧,生成棕褐色的烟 2Fe3+ + SO2 + 2H2O = 2Fe2++SO42- + 4H+
【解析】
由图可知,红褐色沉淀F为Fe(OH)3,溶液D中含硫酸根离子,白色沉淀E为BaSO4,结合元素守恒可知固体C为FeCl3,单质B为Fe,其物质的量为![]() =0.3mol,如A为FeO,其质量为0.3mol×72g/mol=21.6g,如A为Fe2O3,其质量为0.3mol×
=0.3mol,如A为FeO,其质量为0.3mol×72g/mol=21.6g,如A为Fe2O3,其质量为0.3mol×![]() ×160g/mol=24g,A的质量为23.2g,则A应为Fe3O4,满足0.3mol×
×160g/mol=24g,A的质量为23.2g,则A应为Fe3O4,满足0.3mol×![]() ×232g/mol=23.2g,以此来解答。
×232g/mol=23.2g,以此来解答。
(1)由上述分析可知,A为Fe3O4;
(2)Fe在氯气中燃烧生成氯化铁,则现象为剧烈燃烧,生成棕褐色的烟;
(3)C→D在溶液中发生氧化还原反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+。


科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
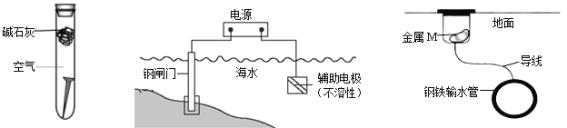
图① 图② 图③
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若断开电源,钢闸门将发生吸氧腐蚀
C. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si三种成分)进行分离、回收再利用的工业流程,通过该流程能得到常用的单质、聚铁(碱式硫酸铁的聚合物)、铁红(Fe2O3)和绿矾(FeSO4·7H2O)。
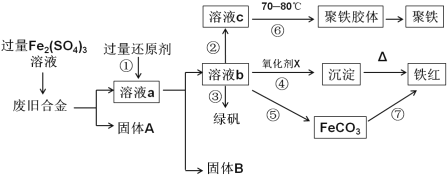
(1)①中过量的还原剂应是____________________。
(2) 向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_______________________。
(3)②中加入H2O2,并调节pH值得到溶液c,在⑥中,将溶液c控制到70-80℃的目的是________。
(4)在③中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有_________________________。
(5)在④中的氧化剂X是________________________。
(6)在⑤中,向溶液b加入了NH4HCO3溶液,得到FeCO3沉淀,写出离子反应方程式 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定试样Fe2O3、Cu、Fe混合物中铜的质量分数,某同学取质量为ag的试样进行下列实验,所得气体数据在标准状况下测得,所涉及的过程如下:

注:已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Cu2+ |
开始沉淀PH | 2.5 | 7.0 | 4.7 |
完全沉淀PH | 3.7 | 9.0 | 6.7 |
下列说法不正确的是
A. 气体B为氢气
B. 溶液A中所含的阳离子可能是H+ 、 Fe3+ 、 Fe2+、 Cu2+
C. 加入过氧化氢溶液时发生的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D. 若沉淀E经洗涤、烘干、灼烧后得到固体mg,则试样中Cu的质量分数=(a-0.56)/a×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。试运用所学知识,回答下列问题:
Ⅰ.已知反应:①CH4(g)+H2O (g) ![]() CO(g)+3H2(g) ΔH=+206 kJ·mol-1
CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②C(s)+H2O (g) ![]() CO(g)+ H2(g) ΔH=+131 kJ·mol-1
CO(g)+ H2(g) ΔH=+131 kJ·mol-1
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白。CH4(g) ![]() C(s)+2H2(g) ΔH=________kJ·mol-1。
C(s)+2H2(g) ΔH=________kJ·mol-1。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1; c(H2O)=5.0 mol·L-1;c (CO)=1.5 mol·L-1;c(H2)=2.0 mol·L-1,则此时该可逆反应的状态是_______(填序号)
a.达到平衡 b.向正反应方向移动 c.向逆反应方向移动
Ⅱ.甲醇是一种可再生能源,工业上用CO与H2来合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g),回答下列问题:
CH3OH(g),回答下列问题:
(1)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,平衡时,下列说法正确的是_______。
A.v(H2)正=v(CH3OH)逆 B.2v(CO)=v(H2)
C.CO与H2转化率相等 D.CO与H2的物质的量之比不再改变
(2)图是该反应在不同温度下CO的转化率随时间变化的曲线。温度T1和T2大小关系是T1____T2(填“>”、“<”或“=”),对应温度的平衡常数大小关系是K1____K2(填“>”、“<”或“=”)。
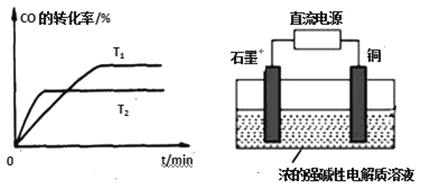
(3)用甲醇燃料电池作为直流电源,设计如图2装置制取Cu2O,写出铜电极的电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验 Cl2的性质。下列说法正确的是( )

A.Ⅰ图:若 MnO2 过量,则浓盐酸可全部消耗完
B.Ⅱ图:证明新制氯水具有酸性和漂白性
C.Ⅲ图:产生了棕黄色的雾
D.Ⅳ图:日光照射烧瓶中的饱和氯水会有气泡产生,这是由于氯气光照条件下溶解度下降而逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究浓硫酸和二氧化硫的性质,设计了如下图所示的装置进行实验(夹持装置已省略):

请回答:
(1)用“可抽动铜丝”代替“直接投入铜片”的优点是_____。
(2)说明SO2气体产生的实验现象是_____。装置⑤的作用是_____。
(3)为了验证SO2是酸性氧化物,③中可选择的试剂是_____。
A.澄清石灰水 B.饱和食盐水 C.碘水 D.品红溶液
(4)下列说法正确的是_____。
A.实验开始后,②和④中溶液均褪色,两者均可证明SO2具有漂白性
B.反应后,将①试管中的白色固体加入水中,溶液呈蓝色
C.先向装置中加入试剂(药品),再进行气密性检查
D.⑤中的NaOH溶液可用Na2CO3溶液代替
(5)若将抽动的铜丝换成炭块进行反应,写出反应的化学方程式_____;该反应体现浓硫酸的_____(选填“脱水性”“吸水性”“强氧化性”“酸性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,在容积固定的密闭容器中发生如下反应:aX(S)+bY(g) ![]() cZ(g)+dW(g) △H>0,下列叙述正确的是
cZ(g)+dW(g) △H>0,下列叙述正确的是
A. 平衡后继续充入X,正反应速率增大
B. 平衡后继续充入X,W的体积分数增大
C. 平衡后通入少量Y,平衡右移,△H增大
D. 恒温,恒容下充入1mol稀有气体He,Z的浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com