
【题目】将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)
CH3OCH3(g)
+3H2O(g),一定条件下,现有两个体积均为1.0L恒容密闭容器甲和乙,在甲中充入0.1molCO2和0.2molH2,在乙中充入0.2molCO2和0.4molH2,发生上述反应并达到平衡。该反应中CO2的平衡转化率随温度的变化曲线如图所示。下列说法正确的是

A.反应2CO2(g)+6H2(g) ![]() CH3OCH3(g) + 3H2O(g)的 △S<0、△H<0
CH3OCH3(g) + 3H2O(g)的 △S<0、△H<0
B.表示乙容器CO2的平衡转化率随温度变化的是曲线B
C.体系中c(CH3OCH3):c(CH3OCH3,状态Ⅱ)<2c(CH3OCH3,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)<v逆(状态Ⅲ)
【答案】AD
【解析】
试题分析:A、反应2CO2(g)+6H2(g) ![]() CH3OCH3(g) + 3H2O(g),反应物气体的物质的量为8mol,生成物气体的物质的量为4mol,则△S<0,根据图中曲线可知,升温,二氧化碳的转化率降低,说明升温,平衡逆向移动,则正反应是放热反应,△H<0,A正确;B、乙的起始量为甲的二倍,恒温恒容下,相当于在甲的基础上加压,平衡会正向移动,二氧化碳的转化率会增大,则曲线A是乙容器,B错误;C、乙的起始量为甲的二倍,恒温恒容下,相当于在甲的基础上加压,平衡会正向移动,则c(CH3OCH3,状态Ⅱ)>2c(CH3OCH3,状态Ⅲ),C错误;D、状态Ⅰ和状态Ⅲ都在B曲线上,升高温度,速率增大,则v逆(状态Ⅰ)<v逆(状态Ⅲ),D正确。答案选AD。
CH3OCH3(g) + 3H2O(g),反应物气体的物质的量为8mol,生成物气体的物质的量为4mol,则△S<0,根据图中曲线可知,升温,二氧化碳的转化率降低,说明升温,平衡逆向移动,则正反应是放热反应,△H<0,A正确;B、乙的起始量为甲的二倍,恒温恒容下,相当于在甲的基础上加压,平衡会正向移动,二氧化碳的转化率会增大,则曲线A是乙容器,B错误;C、乙的起始量为甲的二倍,恒温恒容下,相当于在甲的基础上加压,平衡会正向移动,则c(CH3OCH3,状态Ⅱ)>2c(CH3OCH3,状态Ⅲ),C错误;D、状态Ⅰ和状态Ⅲ都在B曲线上,升高温度,速率增大,则v逆(状态Ⅰ)<v逆(状态Ⅲ),D正确。答案选AD。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
I.取样、氧的固定 .
用溶解氧瓶采集水样,记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
在碘量瓶中将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+(该反应放热),在暗处静置5min,然后用标准Na2S3O3溶液滴定生成的I2(2S2O32-+I2=2I- +S4O62-)。
回答下列问题:
(1)“氧的固定”中发生反应的化学方程式为___________。
(2)水样酸化后发生反应的离子方程式___________。
(3)在碘量瓶(如图)中进行反应,要盖上塞子且在塞子上倒少量水,这样做的目的是___________。
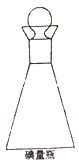
(4)Na2S3O3溶液不稳定,易被氕化,且易受到水中CO2以及微生物的影响而分解,配制该溶液时需要的蒸馏水必须经过煮沸冷却后才能使用,其目的是__________。
(5) Na2S3O3溶液不稳定,使用前需标定,KIO3做基准物标定Na2S3O3溶液的浓度,称取0.214g KIO3与过量的KI作用,析出的碘用Na2S3O3溶液滴定,用去24.00mL,此Na2S3O3溶液的浓度为______(已知M(KIO3) = 214.0g/mol)
(6)取100.00mL水样经固氧、酸化后,用该Na2S3O3溶液滴定,以淀粉溶液作指示剂,终点现象为_____;若消耗Na2S3O3的体积为l0mL,则水样中溶解氧的含量为______mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识,不正确的是
A. 浓硝酸和稀硝酸都具有氧化性
B. 铜与硝酸的反应属于置换反应
C. 浓硝酸在常温下见光或受热会分解
D. 常温下可用铁或铝制品盛装浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)212H2O]的工艺流程如图所示: 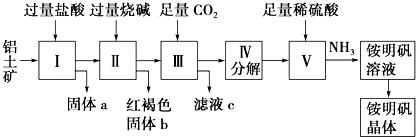 请回答下列问题:
请回答下列问题:
(1)固体a的化学式为 , Ⅲ中通入足量CO2气体发生反应的离子方程式为 .
(2)由Ⅴ 制取铵明矾溶液的化学方程式为 . 从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤.
(3)以1000kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3 , 需消耗质量分数98%的硫酸(密度1.84gcm﹣1)L(计算结果请保留一位小数).
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量.若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。 一定条件下,将0.5mol CO和0.5mol H2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是
CH3OH(g)。 一定条件下,将0.5mol CO和0.5mol H2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用。它的有效成分是下列物质中的一种,这种物质是( )
A. KMnO4 B. NaOH C. NaClO D. K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验: 【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 .
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= .
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究. 
①该小组同学提出的假设是 .
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
③若该小组同学提出的假设成立,应观察到的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2 通入下列溶液中:( )
①BaCl2溶液 ②澄清的石灰水 ③饱和Na2CO3溶液 ④K2SiO3溶液;可能变浑浊的是:
A. ①② B. ①②③ C. ①②③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤
不正确的操作顺序是
A.③②①⑤④ B.③①②⑤④ C.②③①⑤④ D.②①③⑤④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com