
【题目】在甲乙丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g)![]() 2NH3(g) △H<0,相关数据如下表所示:
2NH3(g) △H<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | lmol N2、3molH2 | 2mol NH3 | 2mol NH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/mol ·L-1 | C甲 | C乙 | C丙 |
平衡时NH3的反应速率/mol·L-1·min-1 | v甲 | V乙 | V丙 |
下列说法正确的是
A. V甲>V丙 B. C乙>C甲 C. K乙> K丙 D. V甲= V丙
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
I.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3-,MnO4-被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32-能将I2还原为I-。
【制备氮氧化物】
(1)甲组同学拟利用如下左图所示装置制备氮氧化物。

①仪器X、Y的名称分别是______________、______________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为_____________________ ,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
⑵乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图。
①装置C中导管末端接一玻璃球的作用是________________。
②装置D的作用是______________;装置E的作用是________________。
【测定Ca(NO2)2的纯度】
⑶丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b. c1mol·L-1的KI溶液 c.淀粉溶液
d.c2mol·L-1的Na2S2O3溶液 e.c3mol·L-1 的酸性 KMnO4 溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是______________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,__________________(请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图中所示的装置进行实验,实验现象与预测不一致的是( )

选项 | ①中的物质 | ②中的物质 | 预测现象 |
A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
B | 浓氨水 | 浓盐酸 | ③中有白烟 |
C | 浓硝酸 | 淀粉KI溶液 | ②中溶液无明显变化 |
D | 浓盐酸 | 酚酞溶液 | ②中溶液无明显变化 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
氯贝特(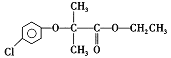 )是临床上一种抗血栓药物,它的一种合成路线如图28(图中部分反应条件及部分反应物、生成物已略去)。
)是临床上一种抗血栓药物,它的一种合成路线如图28(图中部分反应条件及部分反应物、生成物已略去)。
回答下列问题: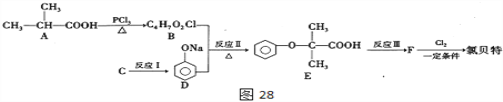
(1)有机物A命名为________,反应II的反应类型为_________,E分子中含有的官能团名称是___________。
(2)要实现反应I的转化,加入下列物质能达到目的有__________。
a. NaHCO3 b. NaOH c.Na2CO3 d. CH3COONa
(3)写出反应Ⅲ的化学方程式__________________________________ 。
(4)产物E有多种同分异构体,满足下列条件的所有同分异构体G有______种。
① 属于酯类且与FeCl3溶液显紫色 ② 能发生银镜反应
③ 1molG最多与2molNaOH反应 ④ 苯环上只有2个取代基且处于对位
其中核磁共振氢谱有五组峰的有机物结构简式为______________________。
(5)结合以上合成路线信息,设计以CH3CH2COOH为原料(无机试剂任选),合成有机物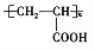 的合成流程。____________
的合成流程。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-38.6kJ·mol-1
2NH3(g)ΔH=-38.6kJ·mol-1
C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同
D.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
B. 6.4g O2和O3的混合气体,含氧原子数为0.4NA
C. 44g二氧化碳气体中含有共用电子对数目为2NA
D. 500mLO.5mol/L盐酸与0.435g MnO2共热后,生成Cl2分子的数目为0.005NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:

(1)“500℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃ 加入H2O2溶液,其目的是_____________。
(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是___________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则c(Mg2+)为________[已知Ksp(MgF2)=7.35×10-11”、 Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.00g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4〕溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,当_________时,即达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的酸性溶液中,能共存的离子组是( )
A. Na+ 、K+、SO42-、HCO3 - B. Cu2+、K+、SO42-、NO3
C. Na+、 K+、Cl、 NO3 D. Fe3+、K+、SO42-、Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理氮氧化物(NOx)的污染是化学研究的重要课题之一。
I.NO能被灼热的铁粉还原为N2,同时生成FeO,利用下列装置模拟该反应。

已知:①浓硝酸可氧化NO;②NaOH溶液能与NO2反应,不与NO反应。
(1)上述装置接口的连接顺序为a→__________(按气流方向,用小写字母表示)。
(2)装置D的作用是___________________。
(3)装置E中反应的化学方程式为___________________。
(4)打开分液漏斗活塞,烧瓶中观察到的实验现象有_____________________。
II.实验室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH=2NaNO2+H2O。设计实验验证产物NaNO2既有氧化性又有还原性。
限选试剂:稀硫酸、KI-淀粉溶液、双氧水、酸性KMnO4溶液
(5)取适量NaNO2溶液,加入_____________,观察到_____________现象,证明其具有氧化性。
(6)参照(5),设计实验证明NaNO2有还原性________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com