
【题目】下列说法正确的是:
A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-38.6kJ·mol-1
2NH3(g)ΔH=-38.6kJ·mol-1
C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同
D.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
【答案】C
【解析】
试题分析:A、甲烷的标准燃烧热为-890.3 kJmol-1,由于水在液态稳定,则甲烷燃烧正确的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJmol-1,故A错误;
B、0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故B错误;C、根据盖斯定律.反应的焓变只与始态和终态有关,与过程无关.所以同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同,故C正确;D、硫酸钙是微溶物,生成硫酸钙为放出热量,故H2SO4和Ca(OH)2反应的中和热△H<2×(-57.3)kJ/mol,故A错误;故选C。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. Na2O2与H2O反应:2![]() +2H2O4OH-+O2↑
+2H2O4OH-+O2↑
B. 金属钠投入水中:Na+2H2O=Na++OH-+H2↑
C. CaCO3与醋酸溶液反应:CaCO3+2H+Ca2++CO2↑+H2O
D. KAl(SO4)2溶液与氨水反应:Al3++3NH3·H2OAl(OH)3↓+3N![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不能得到氢氧化铝沉淀的是 ( )
A. 硫酸铝溶液与过量的氨水混合B. 氯化铝溶液中加入几滴烧碱溶液
C. 偏铝酸钠溶液中加入过量的盐酸D. 偏铝酸钠溶液中通入过量的二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有广泛的应用。
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的反应原理为:
Fe(OH)3 + NaClO + NaOH →Na2FeO4 + X + H2O(未配平), 则X的电子式为_______ ,反应中被氧化的物质是_________(写化学式)。
Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆。工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
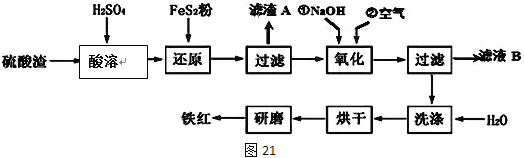
已知:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
已知FeS2是一种黄色难溶于水的固体。
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为______________________;
“滤渣A”主要成份的化学式为__________________。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式_________________。
(3)为确保铁红的质量和纯度,氧化过程中加NaOH调节溶液pH的范围是____;如果加NaOH调节溶液pH=a,则滤液B中c(Fe3+)=____mol/L(25℃时,Ksp[Fe(OH)3]=4×10﹣38)
(4)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池。该电池负极的电极反应式为________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃A为主要原料,采用以下路线合成药物X、Y和高聚物Z。
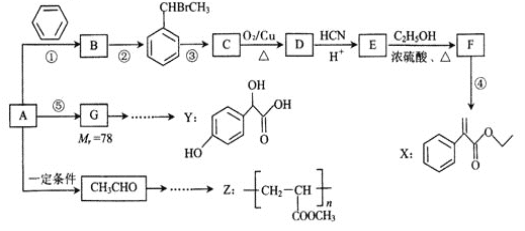
已知:

Ⅱ.反应①、反应②、反应⑤的原子利用率均为100%。
请回答下列问题:
(1)B的名称为______________。
(2)X中的含氧官能团名称为____,反应③的条件为_______,反应③的反应类型是_________。
(3)关于药物Y 的说法正确的是_________________。
的说法正确的是_________________。
A.药物Y的分子式为C8H804,遇氯化铁溶液可以发生显色反应
B.1mol药物Y与H2、浓溴水中的Br2反应,最多消耗分别为4 mol和2 mol
C.1mol药物Y与足量的钠反应可以生成33.6 L氢气
D.药物Y中⑥、⑦、⑧三处- OH的电离程度由大到小的顺序是⑧>⑥>⑦
(4)写出反应E-F的化学方程式_____________________________________。
(5)写出符合下列条件的E的所有同分异构体的结构简式________________________。
①属于酚类化合物,且是苯的对位二元取代物;②能发生银镜反应和水解反应。
(6)设计一条以CH3CHO为起始原料合成Z的线路(无机试剂及溶剂任选) ___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲乙丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g)![]() 2NH3(g) △H<0,相关数据如下表所示:
2NH3(g) △H<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | lmol N2、3molH2 | 2mol NH3 | 2mol NH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/mol ·L-1 | C甲 | C乙 | C丙 |
平衡时NH3的反应速率/mol·L-1·min-1 | v甲 | V乙 | V丙 |
下列说法正确的是
A. V甲>V丙 B. C乙>C甲 C. K乙> K丙 D. V甲= V丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关实验示意图不能达到实验目的的是
A.  探究不同催化剂对H2O2分解速率影响
探究不同催化剂对H2O2分解速率影响
B.  探究温度对2NO2
探究温度对2NO2![]() N2O4平衡影响
N2O4平衡影响
C. 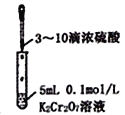 验证Cr2O72-+H2O
验证Cr2O72-+H2O![]() 2CrO42-+2H+平衡状态变化
2CrO42-+2H+平衡状态变化
D. 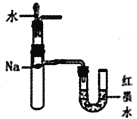 验证钠和水反应的热效应
验证钠和水反应的热效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4mol·L-1的浓硫酸配制250mL 4.8 mol·L-1的硫酸溶液,需量取浓硫酸___________mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需_________。
(2)酸浸时,为了提高浸取率可采取的措施有____________________________。(答出两点)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:______________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4 (>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.滤液Ⅱ中阳离子主要有_________;但溶液的pH不能超过8,其理由是_______________________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是__________________。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:______________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com