
【题目】下列相关实验示意图不能达到实验目的的是
A.  探究不同催化剂对H2O2分解速率影响
探究不同催化剂对H2O2分解速率影响
B.  探究温度对2NO2
探究温度对2NO2![]() N2O4平衡影响
N2O4平衡影响
C. 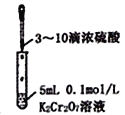 验证Cr2O72-+H2O
验证Cr2O72-+H2O![]() 2CrO42-+2H+平衡状态变化
2CrO42-+2H+平衡状态变化
D. 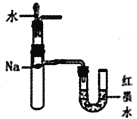 验证钠和水反应的热效应
验证钠和水反应的热效应
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molN2O4充入容积固定为2 L的密闭容器中,发生反应:N2O4![]() 2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。
2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。
(1)下列说法中,一定能说明该反应达到平衡状态的是_________(填序号)。
A.正、逆反应均已停止 B. v(NO2)=2v(N2O4)
C.容器中 c(NO2) : c(N2O4)=2∶1 D.混合气体的密度不变
E.混合气体的压强不变 F.混合气体的颜色不变
(2)0~2 s内反应的平均速率v(NO2)=___________________。
(3)达到平衡时容器中c(N2O4)=______________________。
(4)达到平衡时,N2O4转化率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,图2是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA- ,Ⅲ代表A2-,下列说法正确的是( )
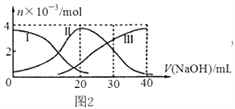
A. H2A在水中的电离方程式是:H2A═2H++A2-
B. 当V(NaOH)=40mL时,其溶液中水的电离受到抑制
C. 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 当V(NaOH)=30mL时,则有:c(H+) +c(Na+)═ c(A2-)+ c(OH-)+ c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-38.6kJ·mol-1
2NH3(g)ΔH=-38.6kJ·mol-1
C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同
D.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A. 工业上常用电解法制备单质b和c B. 31d和33d属于同种核素
C. 气态氢化物的稳定性:d>a>e D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:

(1)“500℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃ 加入H2O2溶液,其目的是_____________。
(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是___________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则c(Mg2+)为________[已知Ksp(MgF2)=7.35×10-11”、 Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.00g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4〕溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,当_________时,即达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(己知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃
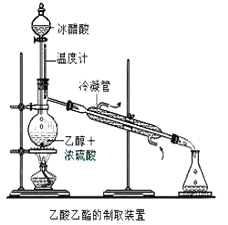
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:_______________。
(3)在该实验中,若用lmol乙醇和lmol乙酸在浓硫酸作用下加热,充分反应,能否生成lmol乙酸乙酯?原因是___________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。

试剂a是__________,试剂b是_______________;分离方法①是________,分离方法②是__________,分离方法③是________________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是____________________。
(6)写出C→D反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属元素的叙述不正确的是( )
A. 金属元素的单质在反应中只能失去电子
B. 金属元素的阳离子只具有氧化性
C. 同一金属元素在不同化合物中的化合价可能相同
D. 金属元素在化合物中一定显正价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关银镜反应的说法中,正确的是( )
A. 配置银氨溶液时氨水必须过量
B. 1 mol甲醛发生银镜反应最多生成2 molAg
C. 银镜反应通常采用水浴加热
D. 铸银镜反应后的试管一般采用浓硝酸洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com