
【题目】下列关于金属元素的叙述不正确的是( )
A. 金属元素的单质在反应中只能失去电子
B. 金属元素的阳离子只具有氧化性
C. 同一金属元素在不同化合物中的化合价可能相同
D. 金属元素在化合物中一定显正价
科目:高中化学 来源: 题型:
【题目】下列反应中不能得到氢氧化铝沉淀的是 ( )
A. 硫酸铝溶液与过量的氨水混合B. 氯化铝溶液中加入几滴烧碱溶液
C. 偏铝酸钠溶液中加入过量的盐酸D. 偏铝酸钠溶液中通入过量的二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关实验示意图不能达到实验目的的是
A.  探究不同催化剂对H2O2分解速率影响
探究不同催化剂对H2O2分解速率影响
B.  探究温度对2NO2
探究温度对2NO2![]() N2O4平衡影响
N2O4平衡影响
C. 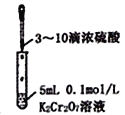 验证Cr2O72-+H2O
验证Cr2O72-+H2O![]() 2CrO42-+2H+平衡状态变化
2CrO42-+2H+平衡状态变化
D. 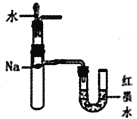 验证钠和水反应的热效应
验证钠和水反应的热效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量铜与100 mL一定浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液加入140mL 5 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的物质的量浓度是( )
A. 5 mol/L B. 7 mol/L C. 10mol/L D. 12 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物性质的说法正确的是
A. 蛋白质可以与酸、碱或重金属盐反应
B. 芳香烃都不能使酸性KMnO4溶液褪色
C. CH3CH2OH与氢溴酸不能反应
D. 石油的分馏可获得乙烯、丙烯等不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性分析:如图甲可通过观察______定性比较得出结论。
同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论______(填“合理”或“不合理”),理由是_____________________。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是______。

(3)加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如上图所示。
①实验时放出气体的总体积是______mL。
②放出1/3气体所需时间为______ min。
③计算H2O2的初始物质的量浓度______。 (请保留两位有效数字)
④A、B、C、D各点反应速率快慢的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4mol·L-1的浓硫酸配制250mL 4.8 mol·L-1的硫酸溶液,需量取浓硫酸___________mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需_________。
(2)酸浸时,为了提高浸取率可采取的措施有____________________________。(答出两点)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:______________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4 (>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.滤液Ⅱ中阳离子主要有_________;但溶液的pH不能超过8,其理由是_______________________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是__________________。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A. 某温度下,若反应后溶液中n(ClO-)=1mol ,n(C1O3-)=2mol,则n(C1-)= 11 mol
B. 参加反应的氯气的物质的量等于0.5amol
C. 上述反应中转移电子的物质的量至少为0.5amol
D. 改变温度,产物中KC1O3的最大理论产量为![]() amol
amol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com