
【题目】阿巴卡韦(Abacavir)是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体 M(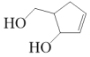 ),下列说法正确的是( )
),下列说法正确的是( )
A.与环戊醇互为同系物B.分子中含有三种官能团
C.能使酸性高锰酸钾溶液和溴水褪色,且原理相同D.可用碳酸钠溶液鉴别乙酸和 M
科目:高中化学 来源: 题型:
【题目】为解决“温室效应”日趋严重的问题,科学家们不断探索CO2的捕获与资源化处理方案,利用CH4捕获CO2并转化为CO和H2混合燃料的研究成果已经“浮出水面”。
已知:①CH4(g)十H2O(g)=CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
T1℃时,在2L恒容密闭容器中加入2molCH4和1molCO2,并测得该研究成果实验数据如下:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
CO2/mol | 1 | 0.7 | 0.6 | 0.54 | 0.5 | 0.5 | 0.5 |
H2/mol | 0 | 0.6 | 0.8 | 0.92 | 1 | 1 | 1 |
请回答下列问题:
(1)该研究成果的热化学方程式③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=__。
(2)30s时CH4的转化率为__,20~40s,v(H2)=__。
(3)T2℃时,该反应的化学平衡常数为1.5,则T2__T1(填“>”“=”或“<”。)
(4)T1℃时反应③达到平衡的标志为__。
A.容器内气体密度不变
B.体系压强恒定
C.CO和H2的体积分数相等且保持不变
D.2v(CO)逆=v(CH4)正
(5)上述反应③达到平衡后,其他条件不变,在70s时再加入2molCH4和1molCO2,此刻平衡的移动方向为__(填“不移动”“正向
(6)由图可知反应在t1、t2、t3时都达到了平衡,而在t2、t4、t8时都改变了条件,试判断t2时改变的条件可能是__。若t4时降低温度,t5时达到平衡,t6时增大了反应物浓度,请补t4~t6时逆反应速率与时间的关系曲线___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的3d轨道上有5个电子,试回答:
的3d轨道上有5个电子,试回答:
(1)M元素原子的核外电子排布式为________
(2)M元素原子的最外层电子数为______,价层电子数为______
(3)M元素在元素周期表中的位置为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N、P同属于元素周期表的第ⅤA族元素,N在第二周期,P在第三周期。![]() 分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H键间的夹角是
分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H键间的夹角是![]() 。
。
(1)![]() 分子的空间结构为
分子的空间结构为![]() ,它是一种_____(填“极性”或“非极性”)分子。
,它是一种_____(填“极性”或“非极性”)分子。
(2)![]() 分子与
分子与![]() 分子的构型关系_____(填“相同”“相似”或“不相似”),P—H键_____(填“有”或“无”)极性,
分子的构型关系_____(填“相同”“相似”或“不相似”),P—H键_____(填“有”或“无”)极性,![]() 分子_______(填“有”或“无”)极性。
分子_______(填“有”或“无”)极性。
(3)![]() 是一种淡黄色油状液体,下列对
是一种淡黄色油状液体,下列对![]() 的有关描述不正确的是___(填字母)。
的有关描述不正确的是___(填字母)。
a.该分子呈平面三角形
b.该分子中的化学键为极性键
c.该分子为极性分子
d.因N—Cl键的键能大,故![]() 稳定
稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g) ![]() NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
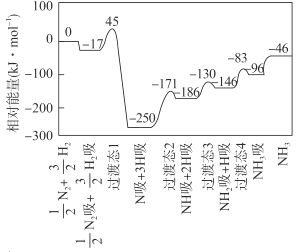
A.该反应的△H = -46 kJ·mol- 1
B.该反应机理中最大活化能为79 kJ·mol- 1
C.升高温度,该反应过渡态的能量会增大
D.该反应达到平衡后增大压强反应正向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在NH4+、Cl-、H+、OH-四种离子。下列各离子浓度关系一定不正确的是( )
A.c(NH4+)+c(H+)=c(Cl-)+c(OH-)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.c(NH4+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下能大量共存的是( )
A.由水电离产生的c(H+)=1×10-10molL-1的溶液中:NO3-、Fe2+、Na+、SO42-
B.![]() =10-10molL-1的溶液中:NH4+、I-、Cl-、K+
=10-10molL-1的溶液中:NH4+、I-、Cl-、K+
C.![]() =1×106的溶液中:K+、Na+、Cl-、HCO3-
=1×106的溶液中:K+、Na+、Cl-、HCO3-
D.惰性电极电解AgNO3后的溶液中:SO32-、K+、Na+、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)基态碳原子的核外电子排布式为______。非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是______(填序号)。
A.甲的金属性比乙强
B.乙有![]() 价
价
C.丙不可能为非金属元素
D.丁一定为金属元素
(3)![]() 、
、![]() 均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 |
|
| |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态![]() 的价电子排布式:______,比较两元素的I2、I3可知,气态
的价电子排布式:______,比较两元素的I2、I3可知,气态![]() 再失去1个电子比气态
再失去1个电子比气态![]() 再失去1个电子难,对此你的解释是______。
再失去1个电子难,对此你的解释是______。
(4)卤族元素![]() 、
、![]() 、
、![]() 、
、![]() 的电负性由小到大的顺序是______。
的电负性由小到大的顺序是______。
(5)基态![]() 原子的电子排布式为______;
原子的电子排布式为______;![]() 和
和![]() 相比,电负性较大的是______;
相比,电负性较大的是______;![]() 中
中![]() 元素的化合价为______。
元素的化合价为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧美三位科学家因“分子机器的设计与合成”研究而荣获2016年诺贝尔化学奖。纳米分子机器研究进程中常见机器的“车轮”组件如下图所示。下列说法正确的是

A. ①③互为同系物 B. ①②③④均属于烃
C. ①④的一氯代物均为三种 D. ②④互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com