
【题目】合成氨反应![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g) ![]() NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
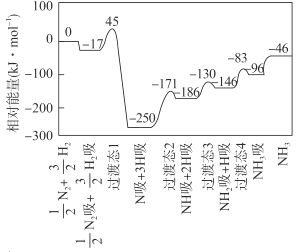
A.该反应的△H = -46 kJ·mol- 1
B.该反应机理中最大活化能为79 kJ·mol- 1
C.升高温度,该反应过渡态的能量会增大
D.该反应达到平衡后增大压强反应正向进行
科目:高中化学 来源: 题型:
【题目】有一含(NaOH 和 Na2CO3 或 Na2CO3 和 NaHCO3)混合碱,现称取试样 0.2960 克,以 0.1000mol·L-1的 HCl 标准溶液滴定,酚酞指示终点时消耗 20.00mL,再以甲基橙指示终点时,消耗盐酸为 VmL
(1)若 20.00<V<40.00 时,混合碱的组成为_______
(2)若 V>40.00,请列式计算以甲基橙指示终点时需要盐酸的体积为多少_______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据门捷列夫的元素周期表,人们总结出下面的元素化学性质的变化规律。该表中元素化学性质的变化表明( )
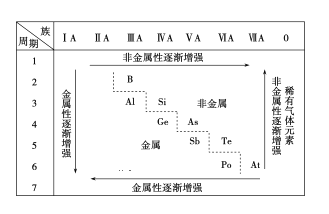
A.同周期元素的性质是相似的
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性弱
D.物质量变到一定程度必然引起质变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作会使最终结果偏高的是( )
A.配制![]() 溶液,定容时俯视刻度线
溶液,定容时俯视刻度线
B.用![]() 盐酸滴定
盐酸滴定![]() 溶液,起始读数时仰视
溶液,起始读数时仰视
C.用湿润的pH试纸测定![]() 溶液的pH
溶液的pH
D.测定中和热的数值时,将![]() 溶液倒入盐酸后,立即读数
溶液倒入盐酸后,立即读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCl(g)分别在有、无催化剂的条件下分解的能量变化如图所示,下列说法正确的是
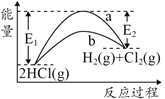
化学键 | H—H | H—Cl | Cl—Cl |
键能kJ·mol-1 | 436 | 431 | 243 |
A.由键能可得1molHCl(g)完全分解需吸收183kJ的能量
B.有催化剂的反应曲线是a曲线
C.a曲线变为b曲线,反应物的活化分子百分数增大
D.b曲线的热化学方程式为:2HCl(g)=H2(g)+Cl2(g) ΔH=-( E1-E2 )kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________,可以认为存在锂元素。
A.紫红色 B.紫色 C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
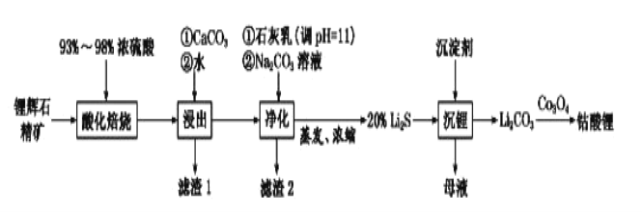
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。
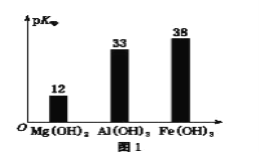
回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________。
②为提高“酸化焙烧”效率,常采取的措施是________。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______。(保留到小数点后一位。已知:完全沉淀后离子浓度低于1×l0-5)mol/L)
④常温下,已知Ksp[ Mg(OH)2]=3.2×10-11mol/L,Ksp[Fe(OH)3]=2.7×10﹣39,若将足量的Mg(OH)2和Fe(OH)3分别投入水中均得到其相应的悬浊液,所得溶液中金属阳离子的浓度分别为____________mol/L、__________mol/L。
⑤“沉锂”过程所获得的“母液”中仍含有大量的Li+,可将其加入到“___________”步骤中。
⑥Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6 ![]() LixC6+Li1-xCoO2 ,其工作原理如图2。
LixC6+Li1-xCoO2 ,其工作原理如图2。
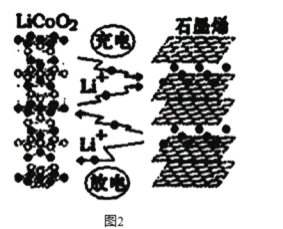
下列关于该电池的说法正确的是___________(填字母)。
A.电池反应式中过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2 极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
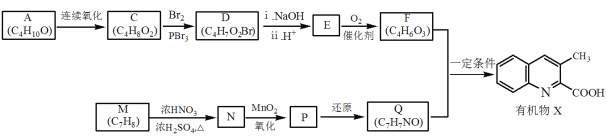
【题目】有机物X是药物的中间体,它的一种合成路线如下。
已知:RNH2+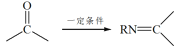 +H2O
+H2O
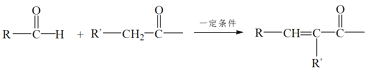
(1)A无支链,A中含有的官能团名称是___。
(2)A连续氧化的步骤如下:
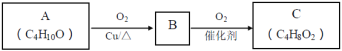
A转化为B的化学方程式是___。
(3)M为芳香化合物,其结构简式是___。
(4)M→N的化学方程式是___,反应类型是___。
(5)下列说法不正确的是___。
a.1molD与NaOH溶液反应时,最多消耗2molNaOH
b.E在一定条件下可生成高分子化合物 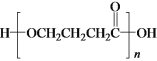
c.F能发生酯化反应和消去反应
(6)Q的结构简式是___。
(7)以乙烯为起始原料,选用必要的无机试剂合成A,写出合成路线___(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:

分析图像,以下结论错误的是( )
A. 析氢腐蚀和吸氧腐蚀的速率一样快
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 溶液pH≤2时,生铁发生析氢腐蚀
D. 两溶液中负极反应均为Fe – 2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常用的发色剂和防腐剂,某学习小组利用如图装置(夹持装置略去)制取亚硝酸钠,已知:2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3;NO能被酸性高锰酸钾氧化为NO3-。下列说法正确的是( )
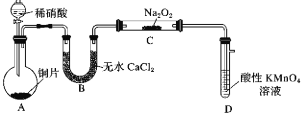
A.可将B中的药品换为浓硫酸
B.实验开始前通一段时间CO2,可制得比较纯净的NaNO2
C.开始滴加稀硝酸时,A中会有少量红棕色气体
D.装置D中溶液完全褪色后再停止滴加稀硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com