
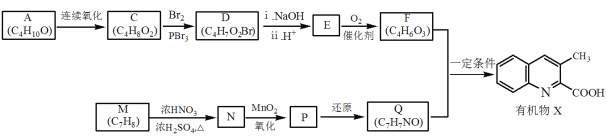
����Ŀ���л���X��ҩ����м��壬����һ�ֺϳ�·�����¡�
��֪��RNH2+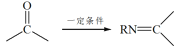 +H2O
+H2O
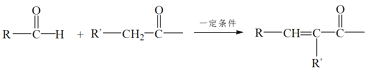
��1��A��֧����A�к��еĹ�����������___��
��2��A���������IJ������£�
Aת��ΪB�Ļ�ѧ����ʽ��___��
��3��MΪ���㻯�����ṹ��ʽ��___��
��4��M��N�Ļ�ѧ����ʽ��___����Ӧ������___��
��5������˵������ȷ����___��
a��1molD��NaOH��Һ��Ӧʱ���������2molNaOH
b��E��һ�������¿����ɸ߷��ӻ����� 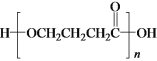
c��F�ܷ���������Ӧ����ȥ��Ӧ
��6��Q�Ľṹ��ʽ��___��
��7������ϩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�A��д���ϳ�·��___���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
���𰸡��ǻ� 2CH3CH2CH2CH2OH+O2![]() 2CH3CH2CH2CHO+2H2O
2CH3CH2CH2CHO+2H2O ![]()
![]() +HNO3
+HNO3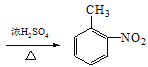 +H2O ȡ����Ӧ c
+H2O ȡ����Ӧ c 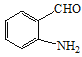 CH2=CH2
CH2=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
��������
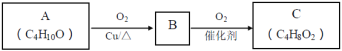
A�ɾ������������õ�C�����ݣ�2����������������Ϣ����֪AΪ1-������BΪ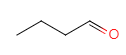 ��CΪ
��CΪ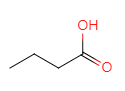 ��C��D����ȡ����Ӧ��DΪ
��C��D����ȡ����Ӧ��DΪ ��D��ˮ�⡢�ữ��õ�E��EΪ
��D��ˮ�⡢�ữ��õ�E��EΪ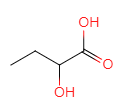 ��E��������������F
��E��������������F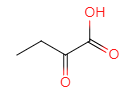 ��M�IJ����Ͷ�Ϊ4���������ղ���X�Ľṹ����֪MΪ�ױ������ݺ��������֪��M��N����������λ��һȡ����Ӧ��NΪ
��M�IJ����Ͷ�Ϊ4���������ղ���X�Ľṹ����֪MΪ�ױ������ݺ��������֪��M��N����������λ��һȡ����Ӧ��NΪ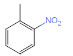 ��N����������ԭ��õ�����Q
��N����������ԭ��õ�����Q ��
��
��������������֪��
��1��AΪ1-������������Ϊ�ǻ���
��2��Aת��ΪBΪ��������Ӧ����ѧ����ʽ��2CH3CH2CH2CH2OH+O2![]() 2CH3CH2CH2CHO+2H2O��
2CH3CH2CH2CHO+2H2O��
��3��M�Ľṹ��ʽΪ![]() ��
��
��4��M��NΪȡ����Ӧ����ѧ����ʽ��![]() +HNO3
+HNO3 +H2O��
+H2O��
a��1molD��NaOH��Һ��Ӧʱ���������2molNaOH��a��ȷ��
b��E��һ�������¿����ɸ߷��ӻ����� ��b��ȷ��
��b��ȷ��
c��F�ܷ���������Ӧ����������ȥ��Ӧ��c����
�ʴ�ѡc��
��6��Q�Ľṹ��ʽ�� ��
��
��7����ϩˮ�����Ҵ����Ҵ�����Ϊ��ȩ��������Ŀ��Ϣ��2����ȩ���ӷ�����Ӧ�������![]() ��
��![]() ����������������Ӧ������1-����������ΪCH2=CH2
����������������Ӧ������1-����������ΪCH2=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2CH2OH��
CH3CH2CH2CH2OH��


 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ײ���MFe2Ox��3��x��4����M��ʾ+2�۵Ľ���Ԫ�أ��ڷ�Ӧ�л��ϼ۲��仯�������£�MFe2Ox��ʹ��ҵ�����е�SO2ת��ΪS��ת�����̱�ʾ��ͼ������˵����ȷ���ǣ�������
![]()
A.x��yB.SO2�Ǹ÷�Ӧ�Ĵ���
C.MFe2Ox�ǻ�ԭ��D.�����ԣ�MFe2Oy��SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������![]()
![]()
![]() ��Һ������˵������ȷ����
��Һ������˵������ȷ����
A.Ӧ��������ƽ��ȡ![]() ����
����![]()
B.���Ʋ�������IJ����������ձ�������������ͷ�ιܡ�500mL����ƿ
C.���ü������ӿ�![]() ������ܽ⣬�����Ѹ�ٽ���Һת��������ƿ��
������ܽ⣬�����Ѹ�ٽ���Һת��������ƿ��
D.����ҡ�Ⱥ�����ҺҺ����ڿ̶��ߣ�����Ҫ�ٵμ�����ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]()
![]() ��
��![]() �Ļ����Һ����μ���
�Ļ����Һ����μ���![]() �����ᣬ����
�����ᣬ����![]() ������������״���£�����������������ϵ��ͼ��ʾ��
������������״���£�����������������ϵ��ͼ��ʾ��
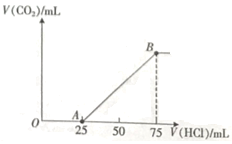
��ش�
��1��OA�η�Ӧ�����ӷ���ʽΪ____��
��2�������Һ��![]() �����ʵ���Ũ��Ϊ____��
�����ʵ���Ũ��Ϊ____��
��3�����ղ���![]() ������������״���£�Ϊ����mL____������С����д��������̣���
������������״���£�Ϊ����mL____������С����д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����˫��������Br2�����ӳɷ�Ӧ���յ����Ǻܶ���ҽ�ֹ����ʳƷ�����ĺϳ�ɫ�أ��ṹ��ʽ��ͼ��ʾ�����й����յ����˵���д�����ǣ�������
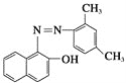
A.�յ������ڷ����廯����B.�յ�������FeCl3��Һ������ɫ��Ӧ
C.�յ����ܱ�����KMnO4��Һ����D.1 mol�յ���������1 mol Br2����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���(Cs)����Ȼ����ֻ��һ���ȶ�ͬλ��![]() Cs����й©�¹��л�����˹�������ͬλ��
Cs����й©�¹��л�����˹�������ͬλ��![]() Cs��
Cs��![]() Cs�������й�˵����ȷ����
Cs�������й�˵����ȷ����
A.�Ԫ�ص����ԭ������ԼΪ133B.![]() Cs��
Cs��![]() Cs��������ͬ
Cs��������ͬ
C.![]() Cs�ĵ�����Ϊ79D.
Cs�ĵ�����Ϊ79D.![]() Cs��
Cs��![]() Cs��Ϊͬ��������
Cs��Ϊͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Br��H2 HBr��H���䷴Ӧ�������������仯��ͼ��ʾ������������ȷ����
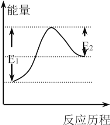
A.�÷�Ӧ�Ƿ��ȷ�Ӧ
B.���������E1��E2�IJ�ֵ��С
C.H��H�ļ��ܴ���H��Br�ļ���
D.��ΪE1>E2�����Է�Ӧ��������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�ס�������װ�ã���ʢ��Һ�����Ũ�Ⱦ���ͬ������������·��ͨ���ĵ��Ӷ���0.1 molʱ������˵����ȷ���ǣ�������

A.��Һ�������仯����С������
B.��ҺpHֵ�仯����С������
C.��ͬ�����²�������������V��=V��
D.�缫��Ӧʽ������������Cu2++2e��=Cu�����и�����Mg��2e��=Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϳɰ��ڹ�ҵ������Ҫ��;��ԭ��������Դ����Ȼ�������������գ�
(1)��Ȼ���е�H2S���ʳ��ð�ˮ���գ�����ΪNH4HS����ǡ����ȫ��Ӧ�������Һ�д���____��ƽ�⡣
(2)һ����������NH4HS��Һ��ͨ�븻������(�����������50%)���õ�������ʹ����Һ������д���÷�Ӧ�Ļ�ѧ����ʽ��___________________�������ı����22.4����������ʱ����________mol����ת�ơ�
(3)H2��������Ȼ����CH4(g)+ H2O(g)![]() 3H2(g)+CO(g)������÷�Ӧ�ں����ܱ������н��У���˵����ﵽ��ѧƽ��״̬����________��(ѡ����)
3H2(g)+CO(g)������÷�Ӧ�ں����ܱ������н��У���˵����ﵽ��ѧƽ��״̬����________��(ѡ����)
a������(H2)������(CO)=3��1 b�������ܶȲ��ٸı�
c��c(H2)��c(CO) =3��1 d�������ƽ����Է����������ֲ���
��ˮ��ʵ���ҳ��õ����
(4)��25��ʱ����a mol/L��ˮ��0.01 mol/L����������ϣ�ƽ��ʱ����Һ��c(NH4+)��c(Cl��)������Һ��_____(������������������������)�ԣ�amol/LNH4Cl��a mol/L��ˮ��������(pH��7)�������Һ���������ʵ���Ũ���ɴ�С˳��___________��
(5)25��ʱCH3COOH��NH3��H2O�ĵ��볣����ȣ�����10 mLŨ��Ϊ0.1mol/L��CH3COOH��Һ�еμ���ͬŨ�ȵİ�ˮ���ڵμӹ�����___________����(ѡ����)
a��ˮ�ĵ���̶�ʼ������
b����������CH3COONH4ʱ���봿ˮ��H2O�ĵ���̶���ͬ
c�������µ�Ũ�ȵ�NH4Cl��CH3COONa����Һ��pH֮��Ϊ14
d�������백ˮ�����Ϊ10 mLʱ��c(NH4+)��c(CH3COO��)
(6)��CaCl2��Һ��ͨ��CO2�����ͣ�������������ͨһ�����������а�ɫ���������õ���ƽ�����۽�����������__________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com