
【题目】已知氮氮双键不能与Br2发生加成反应。苏丹红是很多国家禁止用于食品生产的合成色素,结构简式如图所示。下列关于苏丹红的说法中错误的是( )
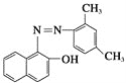
A.苏丹红属于芳香族化合物B.苏丹红能与FeCl3溶液发生显色反应
C.苏丹红能被酸性KMnO4溶液氧化D.1 mol苏丹红最多可与1 mol Br2发生取代反应
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】六价铬有毒,而Cr3+相对安全。工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3。在实验室中模拟这一过程的装置如下:
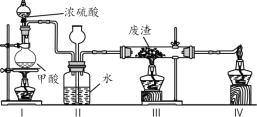
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构简式为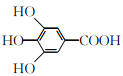 ,下列关于没食子酸的说法正确的是( )
,下列关于没食子酸的说法正确的是( )
A.分子式为C7H7O5
B.能发生加成反应,消去反应和取代反应
C.1 mol没食子酸与足量的钠反应,生成2 mol H2
D.1 mol没食子酸与足量的碳酸氢钠反应,生成4 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是聚合物胶黏剂、涂料等的单体,其一条合成路线如下(部分试剂及反应条件省略):
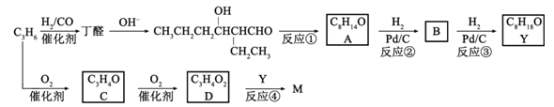
完成下列填空:
(1)反应①的反应类型是____________。反应④的反应条件是_____________。
(2)除催化氧化法外,由A得到![]() 所需试剂为___________。
所需试剂为___________。
(3)已知B能发生银镜反应。由反应②、反应③说明:在该条件下,_______________。
(4)写出结构简式。C________________ M________________
(5)D与1-丁醇反应的产物与氯乙烯共聚可提高聚合物性能,写出该共聚物的结构简式。_____________
(6)写出一种满足下列条件的丁醛的同分异构体的结构简式。____________
①不含羰基②含有3种不同化学环境的氢原子
已知:双键碳上连有羟基的结构不稳定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的催化氧化是工业制取硫酸的关键步骤之一:2SO2 + O2![]() 2SO3 在容积均为2L,有相同催化剂的a、b、c、d、e五个密闭容器中均充入2molSO2和1molO2混合气体,控制不同的反应温度。反应进行5min时,测得相关数据如下表:
2SO3 在容积均为2L,有相同催化剂的a、b、c、d、e五个密闭容器中均充入2molSO2和1molO2混合气体,控制不同的反应温度。反应进行5min时,测得相关数据如下表:
容器温度 物质的量(mol) | a容器 400℃ | b容器 425℃ | c容器 450℃ | d容器 475℃ | e容器 500℃ |
O2 | x | 0.6 | 0.3 | 0.5 | 0.7 |
SO3 | y | 0.8 | 1.4 | 1.0 | 0.6 |
(1)5min时测得a容器中混合气体的物质的量减少了0.2mol,计算5min内SO3的平均反应速率____________。
(2)反应进行到5min时,b容器中的反应是否达到平衡状态?_______(填“是”或“否”),理由是:_____________________________________________________________________________。
(3)在图中画出e容器中SO2物质的量随时间的变化曲线_______________________。
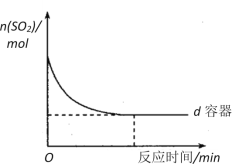
(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:___________________。
(5)已知NaHSO3溶液呈酸性,溶液中c(H2SO3)_______ c(SO32—)(选填<、>或=);NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500L氨气溶于水形成1L氨水,则此氨水的物质的量浓度为____mol·L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是____。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH-=NO2-+NO3-+H2O和NO+NO2+2OH-=____+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为____。
②Cu与Cu2O的物质的量之比为____。
③HNO3的物质的量浓度为____mol·L-1。
(4)有H2SO4和HNO3的混合溶液20mL,加入0.25molL-1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为____mol·L-1,HNO3的物质的量浓度为____mol·L-1。
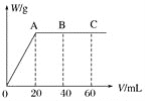
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,代表任何酸碱反应的中和热都是ΔH=-57.3 kJ/mol
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )
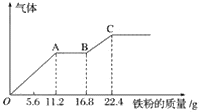
A.图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为硫酸亚铁
B.原溶液中硫酸浓度为2.5 mol·L-1
C.原混合溶液中硝酸根离子的物质的量为0.2 mol
D.图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL![]() 盐酸跟50mL
盐酸跟50mL![]() NaOH溶液中和反应过程中所放出的热量计算中和热。
NaOH溶液中和反应过程中所放出的热量计算中和热。
(1)烧杯间填满泡沫塑料的作用是______;
(2)大烧杯上若不盖硬纸板,求得的中和热数值______![]() 填“偏大”、“偏小”、“无影响”
填“偏大”、“偏小”、“无影响”![]()
(3)如图所示,仪器A的名称是______;

(4)重复三次实验,记录的实验数据如下:
实验用品 | 溶液温度 | |||
|
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
已知:![]() ,反应后溶液的比热容c为
,反应后溶液的比热容c为![]() ,各物质的密度均为
,各物质的密度均为![]() 。计算
。计算![]() ______
______![]()
(5)实验中改用80mL![]() 盐酸跟100mL
盐酸跟100mL![]() NaOH溶液进行反应,与上述实验相比,所放出的热量______
NaOH溶液进行反应,与上述实验相比,所放出的热量______![]() 填“相等、“不相等”
填“相等、“不相等”![]() ,所求中和热______
,所求中和热______![]() 填“相等、“不相等”
填“相等、“不相等”![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com