
【题目】SO2的催化氧化是工业制取硫酸的关键步骤之一:2SO2 + O2![]() 2SO3 在容积均为2L,有相同催化剂的a、b、c、d、e五个密闭容器中均充入2molSO2和1molO2混合气体,控制不同的反应温度。反应进行5min时,测得相关数据如下表:
2SO3 在容积均为2L,有相同催化剂的a、b、c、d、e五个密闭容器中均充入2molSO2和1molO2混合气体,控制不同的反应温度。反应进行5min时,测得相关数据如下表:
容器温度 物质的量(mol) | a容器 400℃ | b容器 425℃ | c容器 450℃ | d容器 475℃ | e容器 500℃ |
O2 | x | 0.6 | 0.3 | 0.5 | 0.7 |
SO3 | y | 0.8 | 1.4 | 1.0 | 0.6 |
(1)5min时测得a容器中混合气体的物质的量减少了0.2mol,计算5min内SO3的平均反应速率____________。
(2)反应进行到5min时,b容器中的反应是否达到平衡状态?_______(填“是”或“否”),理由是:_____________________________________________________________________________。
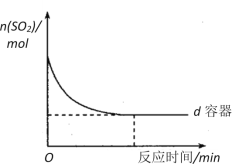
(3)在图中画出e容器中SO2物质的量随时间的变化曲线_______________________。
(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:___________________。
(5)已知NaHSO3溶液呈酸性,溶液中c(H2SO3)_______ c(SO32—)(选填<、>或=);NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_______________
【答案】0.04mol/(Lmin) 否 abc中三氧化硫的物质的量是增大的,de中随温度升高三氧化硫的物质的量是减小的,温度越高,反应速率越快,建立平衡需要的时间越短,证明de是平衡状态,且温度越高,三氧化硫的物质的量越少,b容器的温度低于d,因此三氧化硫的物质的量应该大于d,因此b不是平衡状态 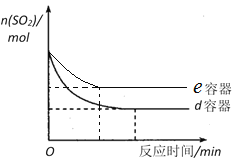 SO32-+SO2+H2O=2HSO3- < 强碱溶液中的氢氧根离子与HSO3-电离出的氢离子反应生成水,促进HSO3-的电离平衡正向移动,反应生成亚硫酸钠
SO32-+SO2+H2O=2HSO3- < 强碱溶液中的氢氧根离子与HSO3-电离出的氢离子反应生成水,促进HSO3-的电离平衡正向移动,反应生成亚硫酸钠
【解析】
(1)根据2SO2 + O2![]() 2SO3 可知,反应中气体的物质的量的减少量等于反应的氧气的物质的量,反应中气体的物质的量减少了0.2mol,即反应的氧气为0.2mol,据此计算5min内三氧化硫的反应速率;
2SO3 可知,反应中气体的物质的量的减少量等于反应的氧气的物质的量,反应中气体的物质的量减少了0.2mol,即反应的氧气为0.2mol,据此计算5min内三氧化硫的反应速率;
(2)五个容器中浓度变化可知,abc中三氧化硫浓度是增大的,de中随温度升高浓度减小,说明温度变化影响化学平衡移动,证明de是平衡状态;
(3)根据五个容器中气体的物质的量变化可知,de容器中是平衡状态,且e容器中反应温度高于d,建立平衡需要的时间少于d,平衡时,SO2物质的量大于d,据此画图;
(4)工业上常用Na2SO3溶液来吸收SO2,该反应生成亚硫酸氢钠;
(5)亚硫酸氢钠溶液中存在亚硫酸氢根离子电离和水解平衡,据此分析判断;强碱溶液中的氢氧根离子能够与HSO3-电离出的氢离子反应生成水,促进HSO3-的电离平衡正向移动,反应生成亚硫酸钠。
(1)根据2SO2 + O2![]() 2SO3 可知,反应中气体的物质的量的减少量等于反应的氧气的物质的量,反应中气体的物质的量减少了0.2mol,即反应的氧气为0.2mol,则生成的SO3 为0.4mol,5min内SO3的平均反应速率v(SO3)=
2SO3 可知,反应中气体的物质的量的减少量等于反应的氧气的物质的量,反应中气体的物质的量减少了0.2mol,即反应的氧气为0.2mol,则生成的SO3 为0.4mol,5min内SO3的平均反应速率v(SO3)=![]() =
=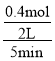 =0.04mol/(Lmin),故答案为:0.04mol/(Lmin);
=0.04mol/(Lmin),故答案为:0.04mol/(Lmin);
(2)根据五个容器中气体的物质的量变化可知,abc中三氧化硫浓度是增大的,de中随温度升高浓度减小,温度越高反应速率越快,建立平衡需要的时间越短,证明de是平衡状态,则反应进行到5min时,b容器中的反应未达到平衡状态,
故答案为:否;abc中三氧化硫的物质的量是增大的,de中随温度升高三氧化硫的物质的量是减小,温度越高反应速率越快,建立平衡需要的时间越短,证明de是平衡状态,且温度越高,三氧化硫的物质的量越少,b容器的温度低于d,因此三氧化硫的物质的量应该大于d;
(3)根据五个容器中气体的物质的量变化可知,de容器中是平衡状态,且e容器中反应温度高于d,建立平衡需要的时间少于d,平衡时,SO2物质的量大于d,变化图象为 ,故答案为:
,故答案为: ;
;
(4)工业上常用Na2SO3溶液来吸收SO2,反应生成亚硫酸氢钠,该反应的离子方程式是:SO32-+SO2+H2O=2HSO3-,故答案为:SO32-+SO2+H2O=2HSO3-;
(5)亚硫酸氢钠溶液中存在亚硫酸氢根离子电离:HSO3-SO32-+H+,电离使溶液显酸性,也存在亚硫酸氢根离子的水解:HSO3-+H2OH2SO3+OH-,水解使溶液显碱性,NaHSO3溶液呈酸性,说明电离程度大于水解程度,因此c(H2SO3)<c(SO32-);强碱溶液中的氢氧根离子能够与HSO3-电离出的氢离子反应生成水,促进HSO3-的电离平衡正向移动,反应生成亚硫酸钠,故答案为:<;强碱溶液中的氢氧根离子能够与HSO3-电离出的氢离子反应生成水,促进HSO3-的电离平衡正向移动,反应生成亚硫酸钠。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。
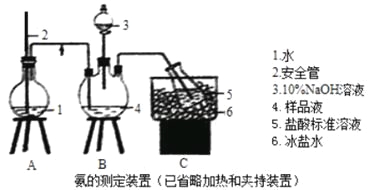
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将___(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是___________;滴定终点时,若溶液中c(Ag+)=2.0×10—5mol·L—1,c(CrO42—)为______mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为______,制备X的化学方程式为____________________;X的制备过程中温度不能过高的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
A. l mol OH﹣所含电子数为10NA
B. 2L0.5 molL﹣1Na2SO4溶液中阴离子所带电荷数为0.2NA
C. 标准状况下,1.12 L CC14含有的氯原子数为0.2NA
D. 14 g由CO和N2组成的混合气体中含有的分子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,质量为m的气体A与质量为n的气体B的分子数相同,下列说法中不正确的是( )
A.气体A与气体B的相对分子质量比为m:n
B.同质量气体A与气体B的分子个数比为n:m
C.同温同压下,A气体与B气体的密度比为n:m
D.相同状况下,同体积的A气体与B气体的质量比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S常用作皮革脱毛剂,工业上用反应Na2SO4 +2C ![]() Na2S+2CO2↑ 进行制取。
Na2S+2CO2↑ 进行制取。
(1)上述反应中涉及的各元素中原子半径最小的是_______(填元素符号),该原子有_____种不同能量的电子。
(2)羰基硫的化学式为COS,结构和CO2 相似,请写出COS的电子式_________,判断羰基硫分子属于________(选填“极性”或“非极性”)分子。
(3)写出一个能比较S和O非金属性强弱的化学事实_____________________ ;请从原子结构解释原因_____________________________。
(4)将Na2S溶液滴入AlCl3溶液中,产生白色沉淀,同时有臭鸡蛋气味的气体生成,用平衡移动原理解释上述现象__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氮氮双键不能与Br2发生加成反应。苏丹红是很多国家禁止用于食品生产的合成色素,结构简式如图所示。下列关于苏丹红的说法中错误的是( )
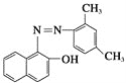
A.苏丹红属于芳香族化合物B.苏丹红能与FeCl3溶液发生显色反应
C.苏丹红能被酸性KMnO4溶液氧化D.1 mol苏丹红最多可与1 mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在指定溶液中,能大量共存的是![]()
![]() 无色溶液中:
无色溶液中:![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]()
![]() 的溶液中:
的溶液中:![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]()
![]() 水电离的
水电离的![]() 浓度
浓度![]() 的溶液中:
的溶液中:![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]()
![]() 加入Mg能放出
加入Mg能放出![]() 的溶液中:
的溶液中:![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]()
![]() 使石蕊变红的溶液中:
使石蕊变红的溶液中:![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]()
![]() 中性溶液中:
中性溶液中:![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() .
.
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。其合成路线如图:
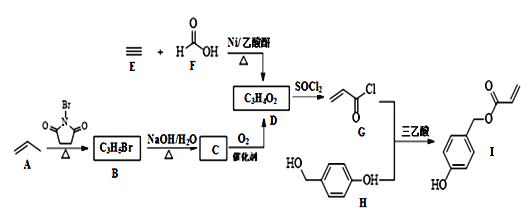
回答下列问题:
(1)I中含氧官能团的名称为____。
(2)由B生成C的化学方程式为__。
(3)由E和F反应生成D的反应类型为____,由G和H反应生成I的反应类型为____。
(4)仅以D为单体合成高分子化合物的化学方程式为___。
(5)X是I的芳香同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。写出两种符合要求的X的结构简式___。
(6)参照本题信息,试写出以1丁烯为原料制取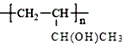 的合成路线流程图(无机原料任选)___。
的合成路线流程图(无机原料任选)___。
合成路线流程图示例如图:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com