
【题目】Ⅰ合成氨在工业上有重要用途,原料氢气来源于天然气。完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,若恰好完全反应,则该溶液中存在____个平衡。
(2)一定条件下向NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:___________________。当消耗标况下22.4升富氧空气时,有________mol电子转移。
(3)H2来自于天然气:CH4(g)+ H2O(g)![]() 3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
a.υ正(H2)∶υ逆(CO)=3∶1 b.气体密度不再改变
c.c(H2)∶c(CO) =3∶1 d.气体的平均相对分子质量保持不变
Ⅱ氨水是实验室常用的弱碱。
(4)在25℃时,将a mol/L氨水与0.01 mol/L盐酸等体积混合,平衡时,溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”、“碱”或“中”)性;amol/LNH4Cl与a mol/L氨水等体积混合(pH>7),混合溶液中微粒的物质的量浓度由大到小顺序:___________。
(5)25℃时CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中___________。 (选填编号)
a.水的电离程度始终增大
b.正好生成CH3COONH4时,与纯水中H2O的电离程度相同
c.常温下等浓度的NH4Cl和CH3COONa两溶液的pH之和为14
d.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
(6)往CaCl2溶液中通入CO2至饱和,无明显现象,再通一定量氨气后有白色沉淀,请用电离平衡理论解释上述现象:__________________________。
【答案】4 2NH4HS+O2→2 NH3·H2O+2S↓ 2 ad 中 c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+) cd 饱和碳酸溶液中电离出的碳酸根离子很少,所以没有沉淀,加入氨水后促进碳酸电离,碳酸根离子浓度增大,产生沉淀
【解析】
Ⅰ(1)H2S电离产生氢离子和硫氢根离子、硫氢根离子电离产生氢离子和硫离子、氨水电离产生铵根离子和氢氧根离子、水电离产生氢离子的氢氧根离子;
(2)NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫,所以反应方程式为:2NH4HS+O2═2NH3H2O+2S↓;当消耗标况下22.4升富氧空气时氧气的体积为11.2L,所以氧气的物质的量为0.5mol;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
Ⅱ(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性;amol/LNH4Cl与amol/L氨水等体积混合(pH>7),说明氨水的电离为主,溶液呈碱性,所以判断离子浓度大小关系;
(5)a.开始时,溶液的酸性逐渐减弱,水的电离程度逐渐增大,当氨水过量后,溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小;
b.正好生成CH3COONH4时,醋酸根和铵根离子水解对水的电离起促进作用,所以与纯水中H2O的电离程度不相同;
c.常温下等浓度的NH4Cl和CH3COONa两溶液的,水解程度相同,而氯化铵水解呈酸性,醋酸钠水解呈碱性,所以pH之和为14;
d.CH3COOH和NH3H2O的电离常数相等,氨水与醋酸的浓度、体积相等时,溶液显示中性,根据电荷守恒可知c(NH4+)=c(CH3COO-);
(6)通入一定量的NH3后使溶液呈碱性,能够生成NH4Cl,饱和H2CO3溶液中电离产生的CO32-很少,因此没有沉淀.加入氨水后,促进H2CO3的电离,CO32-离子浓度增大,有沉淀产生。
(1)H2S电离产生氢离子和硫氢根离子、硫氢根离子电离产生氢离子和硫离子、氨水电离产生铵根离子和氢氧根离子、水电离产生氢离子的氢氧根离子,所以存在4个平衡; (2)NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫,所以反应方程式为:2NH4HS+O2═2NH3H2O+2S↓,当消耗标况下22.4升富氧空气时氧气的体积为11.2L,所以氧气的物质的量为0.5mol,所以转移电子数为:0.5mol×4=2mol;
(3)a.υ正(H2):υ逆(CO)=3:1,正反应和逆反应速率相等,达平衡状态,故a正确;
b.由于是恒容,密度等于质量除以体积,故气体密度一直不变,故b错误;
c.c(H2):c(CO)=3:1,而不是不变,故c错误;
d.气体的平均相对分子质量保持不变,说明气体的物质的量不变,达平衡状态,故d正确;
答案选:ad;
Ⅱ(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl)=0.005mol/L,根据物料守恒得c(NH3·H2O)=(0.5a0.005)mol/L,根据电荷守恒得c(H+)=c(OH)=107mol/L,溶液呈中性,amol/LNH4Cl与amol/L氨水等体积混合(pH>7),说明氨水的电离为主,溶液呈碱性,所以离子浓度大小为:c(NH4+)>c(Cl)>c(NH3H2O)>c(OH)>c(H+);
(5)a.酸溶液、碱溶液抑制了水的电离,溶液显示中性前,随着氨水的加入,溶液中氢离子浓度逐渐减小,水的电离程度逐渐增大;当氨水过量后,随着溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小,所以滴加过程中,水的电离程度先增大后减小,故a错误;
b.正好生成CH3COONH4时,醋酸根和铵根离子水解对水的电离起促进作用,所以与纯水中H2O的电离程度不相同,故b错误;
c.常温下等浓度的NH4Cl和CH3COONa两溶液的,水解程度相同,而氯化铵水解呈酸性,醋酸钠水解呈碱性,所以pH之和为14,故c正确;
d.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH),根据电荷守恒可知:c(NH4+)=c(CH3COO),故d正确;
答案选cd;
(3)通入一定量的NH3后使溶液呈碱性,能够生成NH4Cl,饱和H2CO3溶液中电离产生的CO32很少,因此没有沉淀。加入氨水后,促进H2CO3的电离,CO32离子浓度增大,有沉淀产生。


科目:高中化学 来源: 题型:
【题目】有机物X是药物的中间体,它的一种合成路线如下。
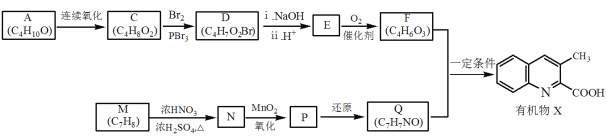
已知:RNH2+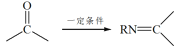 +H2O
+H2O
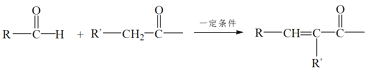
(1)A无支链,A中含有的官能团名称是___。
(2)A连续氧化的步骤如下:
A转化为B的化学方程式是___。
(3)M为芳香化合物,其结构简式是___。
(4)M→N的化学方程式是___,反应类型是___。
(5)下列说法不正确的是___。
a.1molD与NaOH溶液反应时,最多消耗2molNaOH
b.E在一定条件下可生成高分子化合物 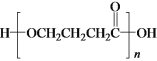
c.F能发生酯化反应和消去反应
(6)Q的结构简式是___。
(7)以乙烯为起始原料,选用必要的无机试剂合成A,写出合成路线___(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿、辉铜矿、斑铜矿等是工业炼铜的常用原料。完成下列计算:
(1)某种黄铜矿中铜的质量分数为0.25,生产1吨纯铜理论上需要这种铜矿_______吨。
(2)实验室以黄铜矿为原料模拟工业炼铜时会产生SO2,用200 mL 1 mol/L的NaOH溶液吸收后,将溶液低温蒸干,得到不含结晶水的固体19.98 g,求所得固体的成分及物质的量。__________
(3)斑铜矿的主要成分M由Cu、Fe、S三种元素组成,其中Cu、Fe元素的质量比为40∶7。常温下将5.04 g M粉末全部溶于过量浓HNO3中,反应后的溶液加水稀释至500 mL,测得其pH=0。向溶液中滴加5 mol/L的NaOH溶液,当加入126 mL后,沉淀质量不再增加,求M的化学式。__________
(4)以辉铜矿为原料火法炼铜,其原理是:
2Cu2S+3O2 → 2Cu2O+2SO2; Cu2S+2Cu2O → 6Cu+SO2↑。
将含3 mol Cu2S的辉铜矿与一定量的空气(氮气、氧气的体积比为4:1)在密闭容器中充分反应(假设各步反应都完全),得到单质铜3 mol,求所得气体中SO2的体积分数。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现某些化合物与水反应时,其中所含的一种元素可以发生自身氧化还原反应。
(1)若A为红棕色气体,B为强酸,C为NO。
①D为单质,其所含元素在元素周期表中的位置是___。
②下列说法中,正确的是___(填字母)。
a.A、C的组成元素相同
b.B的浓溶液可与铜反应得到A
c.A、B、C中含有化合价不同的同种元素
(2)若A为淡黄色固体,B为强碱。
①反应Ⅱ的化学方程式是___。
②若得到标准状况下气体C22.4L,则反应Ⅰ中生成B的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯。目前Cl2O、ClO2、Cl2O7已能制取。
有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是____ 酸的酸酐,Cl2O电子式为____________。
(2)下列能判断Cl和O两种元素非金属性强弱的是______(选填编号)。
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是___________________________。
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是________,氧化产物________。(填离子符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料。完成下列填空:
(1)将0.050mol SO2(g) 和0.030mol O2(g) 充入一个2L的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g)+Q 。经2分钟反应达到平衡,测得n(SO3) = 0.040mol,则O2的平均反应速率为______________________。
2SO3(g)+Q 。经2分钟反应达到平衡,测得n(SO3) = 0.040mol,则O2的平均反应速率为______________________。
(2)在容积不变时,下列措施中有利于提高SO2平衡转化率的有________(选填编号)。
a.移出氧气
b.降低温度
c.减小压强
d.再充入0.050molSO2(g)和0.030molO2(g)
(3)在起始温度T1(673K)时SO2的转化率随反应时间(t)的变化如图。请在图中画出其他条件不变情况下,起始温度为T2(723K)时SO2的转化率随反应时间变化的示意图。________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是( )
2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是( )
A.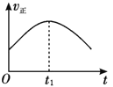 B.
B.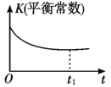
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含铬Cr2O72- 废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3(Cr化合价+3价) 。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(2-x)molB.处理废水中Cr2O72- 的物质的量为![]() mol
mol
C.反应中发生转移的电子为3nx molD.在FeO·FeyCrxO3中3x=y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com