
【题目】某含铬Cr2O72- 废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3(Cr化合价+3价) 。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(2-x)molB.处理废水中Cr2O72- 的物质的量为![]() mol
mol
C.反应中发生转移的电子为3nx molD.在FeO·FeyCrxO3中3x=y
【答案】A
【解析】
A.由铁元素守恒,消耗硫酸亚铁的物质的量为n(y+1),又由FeOFeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,故A错误;
B.根据铬原子守恒,Cr为nxmol,故Cr2O72-的物质的量为![]() mol ,故B正确;
mol ,故B正确;
C.得到n molFeO·FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故反应中发生转移的电子为3nx mol,故C正确;
D.FeO·FeyCrxO3中,Cr正三价,由得失电子守恒知3x—y=0,即3x= y,故D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】Ⅰ合成氨在工业上有重要用途,原料氢气来源于天然气。完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,若恰好完全反应,则该溶液中存在____个平衡。
(2)一定条件下向NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:___________________。当消耗标况下22.4升富氧空气时,有________mol电子转移。
(3)H2来自于天然气:CH4(g)+ H2O(g)![]() 3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
a.υ正(H2)∶υ逆(CO)=3∶1 b.气体密度不再改变
c.c(H2)∶c(CO) =3∶1 d.气体的平均相对分子质量保持不变
Ⅱ氨水是实验室常用的弱碱。
(4)在25℃时,将a mol/L氨水与0.01 mol/L盐酸等体积混合,平衡时,溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”、“碱”或“中”)性;amol/LNH4Cl与a mol/L氨水等体积混合(pH>7),混合溶液中微粒的物质的量浓度由大到小顺序:___________。
(5)25℃时CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中___________。 (选填编号)
a.水的电离程度始终增大
b.正好生成CH3COONH4时,与纯水中H2O的电离程度相同
c.常温下等浓度的NH4Cl和CH3COONa两溶液的pH之和为14
d.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
(6)往CaCl2溶液中通入CO2至饱和,无明显现象,再通一定量氨气后有白色沉淀,请用电离平衡理论解释上述现象:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且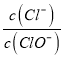 的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后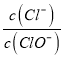 =11,则溶液中
=11,则溶液中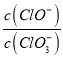 =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n的范围:![]() a mol ≤ n(e -)≤
a mol ≤ n(e -)≤![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 ![]() a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁是一种新型高效的无机高分子絮凝剂。用硫酸亚铁晶体及硫酸为原料催化氧化法生成硫酸铁,再水解、聚合成产品。实验室模拟生产过程如下:
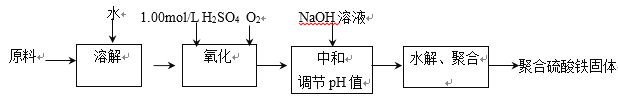
(1)①用原料配制2.50 mol/L的FeSO4溶液时用到的定量仪器有:____________________
②写出氧化过程中的离子方程式:_________________________________________
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为![]() 左右最佳。 加入的硫酸比理论值稍多,但不能过多的原因是____________________________________________________________________。
左右最佳。 加入的硫酸比理论值稍多,但不能过多的原因是____________________________________________________________________。
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(x Fe2O3·y SO3·z H2O),现采用重量法测定x、y、z的值。
①测定时所需的试剂____________。
(a) NaOH (b) Ba(OH)2 (c) BaCl2 (d) FeSO4
②需要测定____________和____________的质量(填写化合物的化学式)。
(4)选出测定过程中所需的基本操作____________(按操作先后顺序列出)。
a.过滤、洗涤
b.蒸发、结晶
c.萃取、分液
d.冷却、称量
e.烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H= -180.5 kJmol1,2H2O(l)=2H2(g)+O2(g) △H=+571.6 kJmol1。
(1)则用H2催化还原NO消除污染的热化学方程式是_______________。
(2)苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10 (g)![]() C8H8(g)+H2(g) △H=+120 kJmol1,某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如表:
C8H8(g)+H2(g) △H=+120 kJmol1,某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
①当反应进行到20min时,该段时间内H2的平均反应速率是__________。
②该温度下,该反应的化学平衡常数是__________。
③若保持其他条件不变,用0.4molH2(g)和0.4molC8H8(g)合成C8H10(g),当有12kJ热量放出时,该反应中H2的转化率是______.此时,该合成反应是否达到了平衡状态?______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。NO2可用下列反应来处理:
6NO2(g)+8NH3(g) ![]() 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
(1)120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡。10min时氧化产物比还原产物多了1.4g,则0~10min时,平均反应速率υ(NO2) = ____________________ ,电子转移了 ___________ 个。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是____________。
a.c(NO2):c(NH3) = 3:4 b.6v(NO2)正 = 7v(N2)逆
c.容器内气体总压强不再变化 d.容器内气体密度不再变化
(3)若保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比_________ (填增大、不变、减小),NO2的转化率 ______________。
(4)一定条件下NO2与SO2可发生反应,方程式:NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
SO3(g)+NO(g) Q。若反应的平衡常数K值变大,该反应___________(选填编号)。
a.一定向正反应方向移动 b. 平衡移动时,逆反应速率先减小后增大
c.一定向逆反应方向移动 d. 平衡移动时,正反应速率先增大后减小
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中进行反应CH4(g) + H2O(g) ![]() CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是

A. p1>p2
B. ΔH<0
C. 加入催化剂可以提高甲烷的转化率
D. 恒温下,缩小容器体积,平衡后CH4浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度是原来的60%,则( )
A.平衡向逆反应方向移动了B.物质A的转化率增加了
C.物质B的质量分数增加了D.a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图装置(夹持装置略,气密性已检验)某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体,下列推断不合理的是
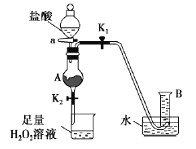
A.B中收集到的气体是氢气
B.烧杯中双氧水溶液作用是将Fe2+还原为Fe3+
C.A中的氧化铁与盐酸反应生成氯化铁
D.烧杯中溶液在氯化氢气氛下,蒸发浓缩、冷却结晶、过滤后得到氯化铁晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com