
【题目】NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H= -180.5 kJmol1,2H2O(l)=2H2(g)+O2(g) △H=+571.6 kJmol1。
(1)则用H2催化还原NO消除污染的热化学方程式是_______________。
(2)苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10 (g)![]() C8H8(g)+H2(g) △H=+120 kJmol1,某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如表:
C8H8(g)+H2(g) △H=+120 kJmol1,某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
①当反应进行到20min时,该段时间内H2的平均反应速率是__________。
②该温度下,该反应的化学平衡常数是__________。
③若保持其他条件不变,用0.4molH2(g)和0.4molC8H8(g)合成C8H10(g),当有12kJ热量放出时,该反应中H2的转化率是______.此时,该合成反应是否达到了平衡状态?______(填“是”或“否”)。
【答案】2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol 0.004mol/(Lmin) 0.1 25% 是
【解析】
(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减得到所需的热化学方程式;
(2)①由化学反应速率公式计算可得;
②建立三段式求解可得;
③依据放出热量计算消耗氢气的量,由转化率公式计算可得;建立三段式求解可得。
(1)将已知反应依次编号为①②,由盖斯定律可知①—②可得H2催化还原NO的热化学方程式2H2(g)+2NO(g)=N2(g)+2H2O(l),则△H=△H1—△H2 =(-180.5 kJ/mol)—(+571.6 kJ/mol)=-752.1kJ/mol,故答案为:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1kJ/mol;
(2)①将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,20min后,剩余0.24mol,则反应消耗了(0.40—0.24)mol=0.16mol,则v(C8H10)=![]() =0.004mol/(L·min),由化学反应速率之比等于化学计量数之比可得v(H2)=0.004mol/(L·min),故答案为:0.004mol/(L·min);
=0.004mol/(L·min),由化学反应速率之比等于化学计量数之比可得v(H2)=0.004mol/(L·min),故答案为:0.004mol/(L·min);
②由表格数据可知,30min已达到平衡,由已知数据建立如下三段式:

由三段式数据可得化学平衡常数K=![]() =
=![]() =0.1,故答案为:0.1;
=0.1,故答案为:0.1;
③当有12kJ热量放出时,反应消耗氢气的物质的量为![]() =0.1mol,则反应中H2的转化率为
=0.1mol,则反应中H2的转化率为![]() ×100%=25%;由逆反应的平衡常数是正反应平衡常数的倒数可知合成C8H10的平衡常数为10,由题意建立如下三段式:
×100%=25%;由逆反应的平衡常数是正反应平衡常数的倒数可知合成C8H10的平衡常数为10,由题意建立如下三段式:

由三段式数据可得浓度熵Qc=![]() =
=![]() =10=K,则反应达到平衡,故答案为:25%;是。
=10=K,则反应达到平衡,故答案为:25%;是。


科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(![]() )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物Ⅰ的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物Ⅰ的一种合成路线:
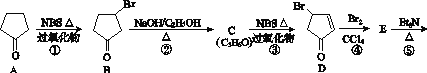
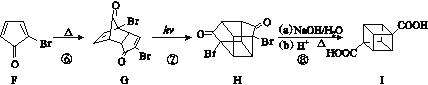
回答下列问题:
(1)C的结构简式为______________,E的结构简式为______________。
(2)③的反应类型为______________,⑤的反应类型为______________。
(3)化合物A可由环戊烷经三步反应合成:
![]()
反应1的试剂与条件为________;反应2的化学方程式为_______________;反应3可用的试剂为________。
(4)在合成I物质的路线中,互为同分异构体的化合物是________(填化合物代号)。
(5)立方烷经硝化可得到六硝基立方烷,其可能的结构有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol冰醋酸和1mol乙醇经催化加热反应可生成H2O分子数为NA
B.常温常压下,将15g NO和8g O2混合,所得混合气体分子总数小于0.5NA
C.标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA
D.6.8g熔融态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含铬Cr2O72- 废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3(Cr化合价+3价) 。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(2-x)molB.处理废水中Cr2O72- 的物质的量为![]() mol
mol
C.反应中发生转移的电子为3nx molD.在FeO·FeyCrxO3中3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行如下反应:H2O(g)+C(s)![]() H2(g)+CO(g) △H>0, 达到平衡后,改变下列反应条件,相关叙述正确的是 ( )
H2(g)+CO(g) △H>0, 达到平衡后,改变下列反应条件,相关叙述正确的是 ( )
A.加入H2O(g),平衡向正反应方向移动,体系压强减小
B.加入CO,混合气体的密度增大
C.降低温度,平衡向正反应方向移动
D.加入少量C,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.1 mol H2SO4),恰好完全反应成盐和水,原混合物中氧元素的质量是
A.6.4gB.3.2gC.1.6gD.0.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应mA(g)+nB(g)![]() qC(g),△H在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断正确的是
qC(g),△H在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断正确的是

A. p1>p2,T1<T2,m+n>q,△H<0
B. p1<p2,T1>T2,m+n>q,△H>0
C. p1>p2,T1<T2,m+n<q,△H<0
D. p1<p2,T1>T2,m+n<q,△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com