
����Ŀ��������(![]() )���и߶ȶԳ��ԡ��������ԡ��������ܼ����ȶ��Ե��ص㣬��˺ϳ������鼰���������Ϊ��ѧ���ע���ȵ㡣��������������������һ�ֺϳ�·�ߣ�
)���и߶ȶԳ��ԡ��������ԡ��������ܼ����ȶ��Ե��ص㣬��˺ϳ������鼰���������Ϊ��ѧ���ע���ȵ㡣��������������������һ�ֺϳ�·�ߣ�
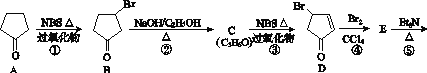
�ش��������⣺
(1)C�Ľṹ��ʽΪ______________��E�Ľṹ��ʽΪ______________��
(2)�۵ķ�Ӧ����Ϊ______________���ݵķ�Ӧ����Ϊ______________��
(3)������A���ɻ����龭������Ӧ�ϳɣ�
![]()
��Ӧ1���Լ�������Ϊ________����Ӧ2�Ļ�ѧ����ʽΪ_______________����Ӧ3���õ��Լ�Ϊ________��
(4)�ںϳ�I���ʵ�·���У���Ϊͬ���칹��Ļ�������________(��������)��
(5)�����龭�����ɵõ������������飬����ܵĽṹ��________�֡�
���𰸡�![]()
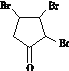 ȡ����Ӧ ��ȥ��Ӧ Cl2/����
ȡ����Ӧ ��ȥ��Ӧ Cl2/���� ![]() ��NaOH
��NaOH![]()
![]() ��NaCl O2/Cu G��H 3
��NaCl O2/Cu G��H 3
��������
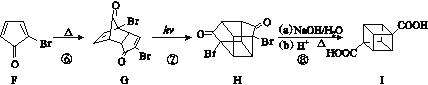
A����ȡ����Ӧ����B��B��ȥ��Ӧ����C��CӦΪ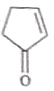 ��C����ȡ����Ӧ����D��E����F������F��D�Ľṹ��ʽ֪��D�����ӳɷ�Ӧ����E��EΪ
��C����ȡ����Ӧ����D��E����F������F��D�Ľṹ��ʽ֪��D�����ӳɷ�Ӧ����E��EΪ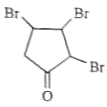 ��E������ȥ��Ӧ����F��F�����ӳɷ�Ӧ����G��G�����ӳɷ�Ӧ����H��H������Ӧ����I���ٽ������������
��E������ȥ��Ӧ����F��F�����ӳɷ�Ӧ����G��G�����ӳɷ�Ӧ����H��H������Ӧ����I���ٽ������������
A����ȡ����Ӧ����B��B��ȥ��Ӧ����C��C����ȡ����Ӧ����D��E����F������F��D�Ľṹ��ʽ֪��D�����ӳɷ�Ӧ����E��E������ȥ��Ӧ����F��F�����ӳɷ�Ӧ����G��G�����ӳɷ�Ӧ����H��H������Ӧ����I��
(1)����B��D�ṹ��ʽ�IJ�����֪��C�Ľṹ��ʽΪ ������F��D�Ľṹ��ʽ֪��D�����ӳɷ�Ӧ����E��E�Ľṹ��ʽΪ
������F��D�Ľṹ��ʽ֪��D�����ӳɷ�Ӧ����E��E�Ľṹ��ʽΪ ��
��
(2)ͨ�����Ϸ����У��۵ķ�Ӧ����Ϊȡ����Ӧ���ݵķ�Ӧ����Ϊ��ȥ��Ӧ��
(3)������������ڹ��������·���ȡ����Ӧ����X![]() ��
��![]() ���������Ƶ�ˮ��Һ����ȡ����Ӧ����Y
���������Ƶ�ˮ��Һ����ȡ����Ӧ����Y![]() ��YΪ
��YΪ![]() ����ͭ���������������·���������Ӧ����
����ͭ���������������·���������Ӧ����![]() �����Է�ӦI���Լ�������ΪCl2/���գ���Ӧ2�Ļ�ѧ����ʽΪ
�����Է�ӦI���Լ�������ΪCl2/���գ���Ӧ2�Ļ�ѧ����ʽΪ![]() ��NaOH
��NaOH![]()
![]() ��NaCl����Ӧ3���õ��Լ�ΪO2/Cu��
��NaCl����Ӧ3���õ��Լ�ΪO2/Cu��
(4)��I�ĺϳ�·���У���Ϊͬ���칹��Ļ�������G��H��
(5)�����龭�����ɵõ������������飬����Hԭ�ӿ��������ڡ�ͬһ��ĶԽ��߶����ϡ�ͨ�����ĵĶԽ��߶����ϣ���������ܵĽṹ��3�֡�


 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д� ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д� ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д� �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ǻ������֢״��ҩ�����ӽṹ��ʽ��ͼ��˵����ȷ����
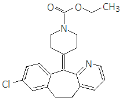
A.�÷����д����ļ�
B.��������12��̼ԭ�ӹ�ƽ��
C.1 mol��������������8 mol���������ӳɷ�Ӧ
D.����NaOH��Һ��Ӧ����������NaHCO3��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ľṹ��ͼ��ʾ�����ڿ��������������ȷ����( )
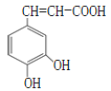
A.����ʽΪC9H8O4
B.1mol�������������4mol���������ӳɷ�Ӧ
C.����ˮ�����ܷ���ȡ����Ӧ���ܷ����ӳɷ�Ӧ
D.�ܻ�ԭ����KMnO4��Һ��˵��������к���̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Cl2ͨ������KOH��Һ�������п�����KCl��KClO��KClO3����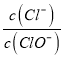 ��ֵ���¶ȸߵ��йء���n (KOH)=a molʱ�������й�˵���������
��ֵ���¶ȸߵ��йء���n (KOH)=a molʱ�������й�˵���������
A.��ij�¶��£���Ӧ��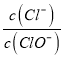 =11������Һ��
=11������Һ��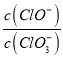 =
=![]()
B.�μӷ�Ӧ�����������ʵ�������![]() a mol
a mol
C.�ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���n�ķ�Χ��![]() a mol �� n(e -)��
a mol �� n(e -)��![]() a mol
a mol
D.�ı��¶ȣ�������KClO3��������۲���Ϊ ![]() a mol
a mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���2L�����ܱ������г���1mol PCl5��������Ӧ��PCl5(g)![]() PCl3(g)+Cl2(g)��Ӧ�����вⶨ�IJ������ݼ�������Ӧ�������������䣩��
PCl3(g)+Cl2(g)��Ӧ�����вⶨ�IJ������ݼ�������Ӧ�������������䣩��
t/s | 0 | 60 | 150 | 250 | 350 | 450 |
n(PCl3)/mol | 0 | 0.12 | 0.19 | 0.2 | 0.2 | x |
��ش��������⣺
��1��x��ֵ��___��
��2��0~60s�ڣ���PCl3��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ������__��
��3��60sʱ��PCl5��ת������__��
��4����ƽ��ʱ��������Cl2�����������__���������һλС�������ɱ������ݼ���������£��÷�Ӧ��ƽ�ⳣ����__mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ���������һ������Ч�����߷������������������������弰����Ϊԭ�ϴ���������������������ˮ�⡢�ۺϳɲ�Ʒ��ʵ����ģ�������������£�
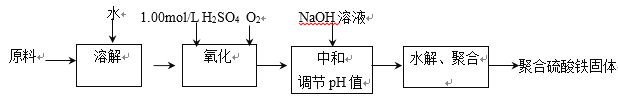
(1)����ԭ������2.50 mol/L��FeSO4��Һʱ�õ��Ķ��������У�____________________
��д�����������е����ӷ���ʽ��_________________________________________
(2)�ۺϿ���ʵ��Ͷ��������������������ʵ���֮��Ϊ![]() ������ѡ� ��������������ֵ�Զ࣬�����ܹ����ԭ����____________________________________________________________________��
������ѡ� ��������������ֵ�Զ࣬�����ܹ����ԭ����____________________________________________________________________��
(3)��������Һˮ����Եõ�һϵ�о��о�ˮ���õļ�ʽ������(x Fe2O3��y SO3��z H2O)���ֲ����������ⶨx��y��z��ֵ��
�ٲⶨʱ������Լ�____________��
(a) NaOH (b) Ba(OH)2 (c) BaCl2 (d) FeSO4
����Ҫ�ⶨ____________��____________������(��д������Ļ�ѧʽ)��
(4)ѡ���ⶨ����������Ļ�������____________(�������Ⱥ�˳���г�)��
a.���ˡ�ϴ��
b.�������ᾧ
c.��ȡ����Һ
d.��ȴ������
e.��ɻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO��NO2�dz������������H2��CO����ԭNO�ɴﵽ������Ⱦ��Ŀ�ġ�
��֪��2NO(g)=N2(g)+O2(g) ��H= -180.5 kJmol1��2H2O(l)=2H2(g)+O2(g) ��H=+571.6 kJmol1��
��1������H2����ԭNO������Ⱦ���Ȼ�ѧ����ʽ��_______________��
��2��������(C8H10)���������ϵ��屽��ϩ(C8H8)���䷴Ӧԭ���ǣ�C8H10 (g)![]() C8H8(g)+H2(g) ��H=+120 kJmol1��ij�¶��£���0.40mol�����飬����2L����ܱ������з�����Ӧ���ⶨ��ͬʱ����������������ʵ������õ����������
C8H8(g)+H2(g) ��H=+120 kJmol1��ij�¶��£���0.40mol�����飬����2L����ܱ������з�����Ӧ���ⶨ��ͬʱ����������������ʵ������õ����������
ʱ��/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
�ٵ���Ӧ���е�20minʱ���ö�ʱ����H2��ƽ����Ӧ������__________��
�ڸ��¶��£��÷�Ӧ�Ļ�ѧƽ�ⳣ����__________��
�������������������䣬��0.4molH2(g)��0.4molC8H8(g)�ϳ�C8H10(g)������12kJ�����ų�ʱ���÷�Ӧ��H2��ת������______.��ʱ���úϳɷ�Ӧ�Ƿ�ﵽ��ƽ��״̬?______(����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£��ܱ������н��з�ӦCH4(g) + H2O(g) ![]() CO(g) + 3H2(g)�����CH4������ٷֺ������¶Ⱥ�ѹǿ�ı仯��ͼ��ʾ������˵����ȷ����
CO(g) + 3H2(g)�����CH4������ٷֺ������¶Ⱥ�ѹǿ�ı仯��ͼ��ʾ������˵����ȷ����

A. p1>p2
B. ��H<0
C. �����������������ת����
D. �����£���С���������ƽ���CH4Ũ�ȼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������£���0.5mol/L�Ĵ�����Һ�м�������ˮ����ˮ�������c(H+)��(OH-)___(���������������С������������)��
��2����֪Ksp(Ag2CrO4) =1.0��10-12����0.2mol/L��AgNO3��Һ�м���������0.008mol/LK2CrO4��Һ�� ����Һ�е�c(CrO42-)=___��
��3�������£�0.1mol/LNaHCO3��Һ��pHֵ___0.1mol/LNa2SO3��Һ��pHֵ(����>������<������=")��
H2CO3 | K1=4.3��10-7 | K2=5.6��10-11 |
H2SO3 | K1=1.54��10-2 | K2=1.02��10-7 |
��֪��
��4����һ�ֿɳ����Na��Al/FeS����ع���ʱNa+�����ʵ������ֲ��䣬�������ú�Na+�ĵ��������Ϊ����ʣ���֪�õ��������ӦʽΪ2Na++FeS+2e-=Na2S+Fe����õ���ڳ��ʱ������������Ӧ��������___���ŵ�ʱ������ӦʽΪ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com