
【题目】氯雷他定是缓解过敏症状的药物,其分子结构简式如图,说法正确的是
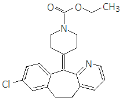
A.该分子中存在肽键
B.最多可以有12个碳原子共平面
C.1 mol氯雷他定最多可与8 mol氢气发生加成反应
D.能与NaOH溶液反应,但不能与NaHCO3溶液反应
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,已知:N2(g)+3H2(g)
分别表示N2、H2、NH3,已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1
下列说法正确的是( )

A.使用催化剂,合成氨反应放出的热量减少
B.②→③过程,是吸热过程且只有H-H键的断裂
C.③→④过程,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收能量小于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)达到平衡,保持温度不变,加入少量水蒸气,体系重新达到平衡,下列说法正确的是
Fe3O4(s)+4H2(g)达到平衡,保持温度不变,加入少量水蒸气,体系重新达到平衡,下列说法正确的是
A.水蒸气的体积分数增大B.氢气的浓度增大
C.平衡常数变大D.铁的质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿、辉铜矿、斑铜矿等是工业炼铜的常用原料。完成下列计算:
(1)某种黄铜矿中铜的质量分数为0.25,生产1吨纯铜理论上需要这种铜矿_______吨。
(2)实验室以黄铜矿为原料模拟工业炼铜时会产生SO2,用200 mL 1 mol/L的NaOH溶液吸收后,将溶液低温蒸干,得到不含结晶水的固体19.98 g,求所得固体的成分及物质的量。__________
(3)斑铜矿的主要成分M由Cu、Fe、S三种元素组成,其中Cu、Fe元素的质量比为40∶7。常温下将5.04 g M粉末全部溶于过量浓HNO3中,反应后的溶液加水稀释至500 mL,测得其pH=0。向溶液中滴加5 mol/L的NaOH溶液,当加入126 mL后,沉淀质量不再增加,求M的化学式。__________
(4)以辉铜矿为原料火法炼铜,其原理是:
2Cu2S+3O2 → 2Cu2O+2SO2; Cu2S+2Cu2O → 6Cu+SO2↑。
将含3 mol Cu2S的辉铜矿与一定量的空气(氮气、氧气的体积比为4:1)在密闭容器中充分反应(假设各步反应都完全),得到单质铜3 mol,求所得气体中SO2的体积分数。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,该溶液呈中性的依据是
A.a=b
B.HA与BOH的电离常数相等
C.混合溶液中,c(H+)=![]() mol/L
mol/L
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现某些化合物与水反应时,其中所含的一种元素可以发生自身氧化还原反应。
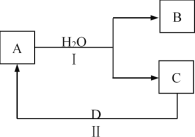
(1)若A为红棕色气体,B为强酸,C为NO。
①D为单质,其所含元素在元素周期表中的位置是___。
②下列说法中,正确的是___(填字母)。
a.A、C的组成元素相同
b.B的浓溶液可与铜反应得到A
c.A、B、C中含有化合价不同的同种元素
(2)若A为淡黄色固体,B为强碱。
①反应Ⅱ的化学方程式是___。
②若得到标准状况下气体C22.4L,则反应Ⅰ中生成B的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料。完成下列填空:
(1)将0.050mol SO2(g) 和0.030mol O2(g) 充入一个2L的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g)+Q 。经2分钟反应达到平衡,测得n(SO3) = 0.040mol,则O2的平均反应速率为______________________。
2SO3(g)+Q 。经2分钟反应达到平衡,测得n(SO3) = 0.040mol,则O2的平均反应速率为______________________。
(2)在容积不变时,下列措施中有利于提高SO2平衡转化率的有________(选填编号)。
a.移出氧气
b.降低温度
c.减小压强
d.再充入0.050molSO2(g)和0.030molO2(g)
(3)在起始温度T1(673K)时SO2的转化率随反应时间(t)的变化如图。请在图中画出其他条件不变情况下,起始温度为T2(723K)时SO2的转化率随反应时间变化的示意图。________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(![]() )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物Ⅰ的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物Ⅰ的一种合成路线:
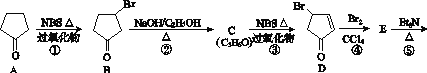
回答下列问题:
(1)C的结构简式为______________,E的结构简式为______________。
(2)③的反应类型为______________,⑤的反应类型为______________。
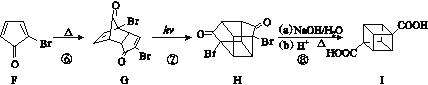
(3)化合物A可由环戊烷经三步反应合成:
![]()
反应1的试剂与条件为________;反应2的化学方程式为_______________;反应3可用的试剂为________。
(4)在合成I物质的路线中,互为同分异构体的化合物是________(填化合物代号)。
(5)立方烷经硝化可得到六硝基立方烷,其可能的结构有________种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com