
【题目】黄铜矿、辉铜矿、斑铜矿等是工业炼铜的常用原料。完成下列计算:
(1)某种黄铜矿中铜的质量分数为0.25,生产1吨纯铜理论上需要这种铜矿_______吨。
(2)实验室以黄铜矿为原料模拟工业炼铜时会产生SO2,用200 mL 1 mol/L的NaOH溶液吸收后,将溶液低温蒸干,得到不含结晶水的固体19.98 g,求所得固体的成分及物质的量。__________
(3)斑铜矿的主要成分M由Cu、Fe、S三种元素组成,其中Cu、Fe元素的质量比为40∶7。常温下将5.04 g M粉末全部溶于过量浓HNO3中,反应后的溶液加水稀释至500 mL,测得其pH=0。向溶液中滴加5 mol/L的NaOH溶液,当加入126 mL后,沉淀质量不再增加,求M的化学式。__________
(4)以辉铜矿为原料火法炼铜,其原理是:
2Cu2S+3O2 → 2Cu2O+2SO2; Cu2S+2Cu2O → 6Cu+SO2↑。
将含3 mol Cu2S的辉铜矿与一定量的空气(氮气、氧气的体积比为4:1)在密闭容器中充分反应(假设各步反应都完全),得到单质铜3 mol,求所得气体中SO2的体积分数。__________
【答案】4吨 n(NaHSO3)=0.18 mol;n(Na2SO3)=0.01 mol Cu5FeS4(或FeCu5S4) 若Cu2S过量,SO2%=20%,若Cu2O过量,SO2%=16.7%。
【解析】
(1)根据元素守恒,矿石中铜的质量等于纯铜的质量计算;
(2)NaOH的物质的量n(NaOH)=1 mol/L×0.2 L=0.2 mol,假设固体全为Na2SO3,则其质量为m(Na2SO3)=![]() ×0.2 mol×126 g/mol=12.6 g<19.98 g;假设固体全是NaHSO3,则其质量为m(NaHSO3)=0.2 mol×104 g/mol=20.8 g>19.98 g,故固体为Na2SO3、NaHSO3的混合物,根据钠离子守恒与二者总质量列方程计算各自物质的量;
×0.2 mol×126 g/mol=12.6 g<19.98 g;假设固体全是NaHSO3,则其质量为m(NaHSO3)=0.2 mol×104 g/mol=20.8 g>19.98 g,故固体为Na2SO3、NaHSO3的混合物,根据钠离子守恒与二者总质量列方程计算各自物质的量;
(3)根据Cu、Fe元素的质量比为40:7计算n(Cu):n(Fe),当加水稀释至500 L时测得其pH为0,此时氢离子浓度为1 mol/L,氢氧化钠先中和氢离子,然后将金属离子转化为沉淀,此时根据元素守恒可计算消耗氢氧化钠的物质的量n(NaOH)=2n(Cu2+)+3n(Fe3+)+n(H+),联立可以计算n(Cu)、n(Fe),进而计算S元素物质的量,再计算三元素物质的量之比确定化学式;
(4)已知2Cu2S+3O2→2Cu2O+2SO2,Cu2S+2Cu2O→6Cu+SO2↑,反应得到单质铜3 mol,根据方程式计算生成二氧化硫,结合空气中氧气和氮气的含量计算。
(1)黄铜矿中铜的质量分数为0.25,则生产1吨纯铜,需矿石的质量m=1吨÷0.25=4吨;
(2)200 mL 1 mol/L的NaOH溶液中含NaOH的物质的量为n(NaOH)=1 mol/L×0.2 L=0.2 mol,根据Na元素守恒,用极值方法计算,假设反应后得到的固体全为Na2SO3,m(Na2SO3)=![]() ×0.2 mol×126 g/mol=12.6 g<19.98g;假设反应得到的固体全是NaHSO3,则其质量为m(NaHSO3)=0.2 mol×104 g/mol=20.8 g>19.98 g,说明得到固体为Na2SO3、NaHSO3的混合物,设Na2SO3、NaHSO3的物质的量分别为x mol、y mol,则:由二者总质量:126x+104y=19.98
×0.2 mol×126 g/mol=12.6 g<19.98g;假设反应得到的固体全是NaHSO3,则其质量为m(NaHSO3)=0.2 mol×104 g/mol=20.8 g>19.98 g,说明得到固体为Na2SO3、NaHSO3的混合物,设Na2SO3、NaHSO3的物质的量分别为x mol、y mol,则:由二者总质量:126x+104y=19.98
根据Na元素守恒:2x+y=0.2,解得x=0.01 mol,y=0.18 mol,所以最后所得固体中含有Na2SO3为0.01 mol,NaHSO3为0.18 mol;
(3)由斑铜矿Cu、Fe元素的质量比为40:7,可得二者的物质的量的比n(Cu):n(Fe)=![]() :
:![]() =5:1,当加水稀释至500 L时测得其pH为0,此时氢离子浓度为c(H+)=1 mol/L,向溶液中滴加5 mol/L的NaOH溶液,NaOH先中和溶液中H+,然后将Cu2+、Fe3+转化为Cu(OH)2、Fe(OH)3沉淀,所以根据Na元素守恒,当恰好形成沉淀时,溶液2n(Cu2+)+3n(Fe3+)=5 mol/L×0.126 L-1 mol/L×0.5 L=0.13 mol,两式联立解得:n(Cu)=0.05 mol,n(Fe)=0.01 mol,
=5:1,当加水稀释至500 L时测得其pH为0,此时氢离子浓度为c(H+)=1 mol/L,向溶液中滴加5 mol/L的NaOH溶液,NaOH先中和溶液中H+,然后将Cu2+、Fe3+转化为Cu(OH)2、Fe(OH)3沉淀,所以根据Na元素守恒,当恰好形成沉淀时,溶液2n(Cu2+)+3n(Fe3+)=5 mol/L×0.126 L-1 mol/L×0.5 L=0.13 mol,两式联立解得:n(Cu)=0.05 mol,n(Fe)=0.01 mol,
故斑铜矿中S元素的质量m(S)=5.04 g-0.01 mol×56 g/mol-0.05 mol×64 g/mol=1.28 g,则n(S)=![]() =0.04 mol,n(Fe):n(Cu): n(S)= 0.01 mol:0.05 mol:0.04mol=1:5:4,所以M的化学式为FeCu5S4;
=0.04 mol,n(Fe):n(Cu): n(S)= 0.01 mol:0.05 mol:0.04mol=1:5:4,所以M的化学式为FeCu5S4;
(4)将含3 mol Cu2S的辉铜矿与一定量的空气(氮气、氧气的体积比4:1)在密闭容器中充分反应(假设各步反应都完全),得到单质铜3 mol。
若Cu2S过量,由2Cu2S+3O2→2Cu2O+2SO2可知1 mol Cu2S反应会消耗1.5 mol O2,反应产生1 mol Cu2O![]() ×100%=20%;
×100%=20%;
若Cu2O过量,由Cu2S+2Cu2O→6Cu+SO2↑可知反应产生3 mol Cu,会同时产生0.5 mol SO2,反应消耗0.5 mol Cu2S和1 mol Cu2O,发生2Cu2S+3O2→2Cu2O+2SO2的Cu2S为2.5 mol,反应消耗3.75 mol O2,同时得到2.5 mol Cu2O和2.5 mol SO2,反应消耗氧气为3.75 mol,氮气的物质的量是氧气的4倍,则氮气的物质的量为3.75 mol ×4=15 mol,共生成的SO2为0.5 mol+2.5 mol=3 mol,则所得气体中的SO2的体积分数为:![]() ×100%=16.7%。
×100%=16.7%。


科目:高中化学 来源: 题型:
【题目】实验室需配制![]()
![]()
![]() 溶液,下列说法不正确的是
溶液,下列说法不正确的是
A.应用托盘天平称取![]() 晶体
晶体![]()
B.配制操作必需的玻璃仪器是烧杯、玻璃棒、胶头滴管、500mL容量瓶
C.采用加热来加快![]() 晶体的溶解,需趁热迅速将溶液转移至容量瓶中
晶体的溶解,需趁热迅速将溶液转移至容量瓶中
D.定容摇匀后发现溶液液面低于刻度线,不需要再滴加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Br+H2 HBr+H,其反应的历程与能量变化如图所示,以下叙述正确的是
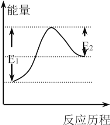
A.该反应是放热反应
B.加入催化剂,E1-E2的差值减小
C.H-H的键能大于H-Br的键能
D.因为E1>E2,所以反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1 mol时,下列说法正确的是( )

A.溶液的质量变化:甲减小乙增大
B.溶液pH值变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极:Cu2++2e﹣=Cu,乙中负极:Mg﹣2e﹣=Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述正确的是( )
A. 淀粉、油脂和蛋白质都是天然高分子化合物
B. 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
C. 14C可用于文物年代的鉴定,14C与12C互为同素异形体
D. 从海水中可以得到NaCl,电解饱和NaCl溶液可以得到金属Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20molL-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010molL-1KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①、②是探究__________对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__________;乙是实验需要测量的物理量,则表格中“乙”应填写__________。
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取1.260 g纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05 000 mol·L-1的KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式_____________________。
(3)某学生的滴定方式(夹持部分略去)如图,最合理的是___________(选填 a、b)。

(4)由图可知消耗KMnO4溶液体积为________________mL。

(5)滴定过程中眼睛应注视______。
(6)通过上述数据,求得x=_______。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果____________(偏大、偏小或没有影响) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯雷他定是缓解过敏症状的药物,其分子结构简式如图,说法正确的是
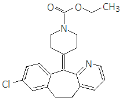
A.该分子中存在肽键
B.最多可以有12个碳原子共平面
C.1 mol氯雷他定最多可与8 mol氢气发生加成反应
D.能与NaOH溶液反应,但不能与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ合成氨在工业上有重要用途,原料氢气来源于天然气。完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,若恰好完全反应,则该溶液中存在____个平衡。
(2)一定条件下向NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:___________________。当消耗标况下22.4升富氧空气时,有________mol电子转移。
(3)H2来自于天然气:CH4(g)+ H2O(g)![]() 3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
a.υ正(H2)∶υ逆(CO)=3∶1 b.气体密度不再改变
c.c(H2)∶c(CO) =3∶1 d.气体的平均相对分子质量保持不变
Ⅱ氨水是实验室常用的弱碱。
(4)在25℃时,将a mol/L氨水与0.01 mol/L盐酸等体积混合,平衡时,溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”、“碱”或“中”)性;amol/LNH4Cl与a mol/L氨水等体积混合(pH>7),混合溶液中微粒的物质的量浓度由大到小顺序:___________。
(5)25℃时CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中___________。 (选填编号)
a.水的电离程度始终增大
b.正好生成CH3COONH4时,与纯水中H2O的电离程度相同
c.常温下等浓度的NH4Cl和CH3COONa两溶液的pH之和为14
d.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
(6)往CaCl2溶液中通入CO2至饱和,无明显现象,再通一定量氨气后有白色沉淀,请用电离平衡理论解释上述现象:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且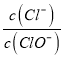 的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后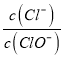 =11,则溶液中
=11,则溶液中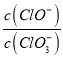 =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n的范围:![]() a mol ≤ n(e -)≤
a mol ≤ n(e -)≤![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 ![]() a mol
a mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com