
【题目】化学学习小组进行如下实验。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20molL-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010molL-1KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①、②是探究__________对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为__________;乙是实验需要测量的物理量,则表格中“乙”应填写__________。
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取1.260 g纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05 000 mol·L-1的KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式_____________________。
(3)某学生的滴定方式(夹持部分略去)如图,最合理的是___________(选填 a、b)。

(4)由图可知消耗KMnO4溶液体积为________________mL。

(5)滴定过程中眼睛应注视______。
(6)通过上述数据,求得x=_______。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果____________(偏大、偏小或没有影响) 。
【答案】温度 1.0 溶液褪色时间/s ![]() b 20.00 锥形瓶中颜色变化 2 偏小
b 20.00 锥形瓶中颜色变化 2 偏小
【解析】
(1)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致;要探究H2C2O4溶液浓度不同对反应速率的影响,则加入的H2C2O4溶液的体积不同,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积均为6mL;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短;
(2)H2C2O4溶液和酸性KMnO4溶液反应生成二氧化碳、锰离子和水;
(3)据高锰酸钾具有强氧化性选择;
(4)根据滴定管的结构、精确度以及测量原理来解答;
(5)据滴定终点的判断是溶液中颜色的变化来分析;
(6)据此![]() 离子方程式来计算;据滴定过程中眼睛应注视溶液中颜色变化,来判断滴定终点分析;根据 c(待测)=
离子方程式来计算;据滴定过程中眼睛应注视溶液中颜色变化,来判断滴定终点分析;根据 c(待测)=![]() 分析不当操作对V(标准)的影响,以此判断浓度的误差。
分析不当操作对V(标准)的影响,以此判断浓度的误差。
(1)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,通过比较实验①②的反应条件可知,实验①②可探究温度对反应速率的影响;实验②③中的H2C2O4溶液的加入体积不同,故要探究H2C2O4溶液浓度不同对反应速率的影响,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积均为6.0mL,则a的值为1.0;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短,故乙要测量的物理量是溶液褪色的时间(t溶液褪色时间/s);
故答案为:温度;1.0;溶液褪色时间/s
(2)H2C2O4溶液和酸性KMnO4溶液反应生成二氧化碳、锰离子和水,其反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
(3)高锰酸钾溶液呈强氧化性,应盛放在酸式滴定管中,
故答案为:b
(4)仪器A的名称是酸式滴定管;滴定管滴定前后读数为:0.90mL,20.90mL,消耗KMnO4溶液体积为20.90mL-0.90mL=20.00mL,
故答案为:20.00;
(5)据酸性KMnO4溶液为紫红色,滴定终点时无色变为紫红色,且半分钟不褪色为滴定终点,故眼睛应注视溶液中颜色变化,
故答案为:锥形瓶中颜色变化
(6)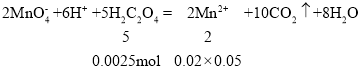
m(H2C2O4)=0.0025×90=0.225g;
m(H2C2O4xH2O)=1.26×![]() =0.315g;
=0.315g;
m(H2O)=0.315-0.225=0.09g;
n(H2O)=![]() =0.005mol①
=0.005mol①
又因为n(H2C2O4)=0.0025mol,根据元素守恒即n(H2C2O4xH2O)=0.0025mol;n(H2O)=0.0025x②
联立①②得0.005=0.0025x解得x=2;
未用标准KMnO4溶液润洗滴定管,溶液被稀释,造成V(标准)偏大,n(H2C2O4)偏大,x将偏小,
故答案为:2;偏小。


科目:高中化学 来源: 题型:
【题目】某同学进行SO2的性质实验。在点滴板a、b、c、d处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如表所示。下列说法正确的是( )
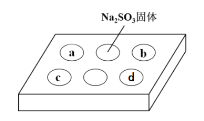
序号 | 试剂 | 实验现象 |
a | 品红溶液 | 红色褪去 |
b | 酸性KMnO4溶液 | 紫色褪去 |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
d | H2S溶液 | 黄色浑浊 |
A.在浓硫酸与Na2SO3固体反应中,浓硫酸表现的强氧化性
B.a、b均表明SO2具有漂白性
C.c中只可能发生反应:SO2+2OH-=SO32-+H2O
D.d中表明SO2具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下(T=500K),有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入1gSO2和1gO2,乙容器中充入2gSO2和2gO2。下列叙述中错误的是( )
A.化学反应速率:乙>甲B.平衡时O2的浓度:乙>甲
C.平衡时SO2的转化率:乙>甲D.平衡时SO2的体积分数:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.焦炭可用于制备电石、生产水煤气等。完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是___________;其与水反应的化学方程式为______________________。
(2)制备电石还需要用到CaCO3。组成CaCO3的三种元素原子半径按从大到小的顺序排列为____________。氧原子的核外电子排布式为_________________。
(3)与同主族元素Mg相比,Ca的金属性更______(填“强”或者“弱”)。能证明这一结论的实验事实是________________________。
II.用焦炭生产水煤气的反应为:C(s)+H2O(g)![]() CO(g)+H2(g)。完成下列填空:
CO(g)+H2(g)。完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是____________。(选填编号)
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2 L的恒容密闭容器中,进行反应,得到如下数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | C | H2 | CO | |||
1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为____________。
②下列图像正确的是________。(选填编号)
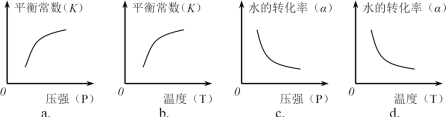
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿、辉铜矿、斑铜矿等是工业炼铜的常用原料。完成下列计算:
(1)某种黄铜矿中铜的质量分数为0.25,生产1吨纯铜理论上需要这种铜矿_______吨。
(2)实验室以黄铜矿为原料模拟工业炼铜时会产生SO2,用200 mL 1 mol/L的NaOH溶液吸收后,将溶液低温蒸干,得到不含结晶水的固体19.98 g,求所得固体的成分及物质的量。__________
(3)斑铜矿的主要成分M由Cu、Fe、S三种元素组成,其中Cu、Fe元素的质量比为40∶7。常温下将5.04 g M粉末全部溶于过量浓HNO3中,反应后的溶液加水稀释至500 mL,测得其pH=0。向溶液中滴加5 mol/L的NaOH溶液,当加入126 mL后,沉淀质量不再增加,求M的化学式。__________
(4)以辉铜矿为原料火法炼铜,其原理是:
2Cu2S+3O2 → 2Cu2O+2SO2; Cu2S+2Cu2O → 6Cu+SO2↑。
将含3 mol Cu2S的辉铜矿与一定量的空气(氮气、氧气的体积比为4:1)在密闭容器中充分反应(假设各步反应都完全),得到单质铜3 mol,求所得气体中SO2的体积分数。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化和液化是目前实现煤综合利用的主要途径之一。以粗煤为原料合成甲醇的流程如下:

(1)煤燃烧产生的大气污染物中,能形成酸雨的有___(填字母)。
a.SO2 b.NOx
(2)过程Ⅱ中的主要反应为:C+H2O=CO+H2,反应类型是___。
(3)过程Ⅲ中反应的化学方程式是___。
(4)将煤加工处理的意义是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现某些化合物与水反应时,其中所含的一种元素可以发生自身氧化还原反应。
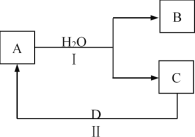
(1)若A为红棕色气体,B为强酸,C为NO。
①D为单质,其所含元素在元素周期表中的位置是___。
②下列说法中,正确的是___(填字母)。
a.A、C的组成元素相同
b.B的浓溶液可与铜反应得到A
c.A、B、C中含有化合价不同的同种元素
(2)若A为淡黄色固体,B为强碱。
①反应Ⅱ的化学方程式是___。
②若得到标准状况下气体C22.4L,则反应Ⅰ中生成B的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯。目前Cl2O、ClO2、Cl2O7已能制取。
有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是____ 酸的酸酐,Cl2O电子式为____________。
(2)下列能判断Cl和O两种元素非金属性强弱的是______(选填编号)。
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是___________________________。
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是________,氧化产物________。(填离子符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化汞(HgCl2)可用于木材和解剖标本的保存、皮革鞣制和钢铁镂蚀,是分析化学的重要试剂,还可做消毒剂和防腐剂。HgCl2在水中稍有水解:HgCl2+H2O![]() Hg(OH)Cl+HCl
Hg(OH)Cl+HCl
(1)为了抑制上述反应中HgCl2的水解,可以采取的措施是_________。(选填编号)
a.加水稀释 b. 增加HCl的浓度 c.及时移走产物 d.降温
(2)HgCl2与稀氨水反应则生成难溶解的氨基氯化汞,化学方程式为HgCl2+2NH3→Hg(NH2)Cl↓+NH4Cl,上述反应的短周期元素中,非金属性最强元素原子的最外层轨道排布式为__________,该原子核外电子云有_________种不同的伸展方向。
(3)已知PCl3与NH3分子结构相似,PCl3的电子式是_______________;PCl3与NH3的沸点比较,______高,其原因是_______________________。
(4)氮的一种氢化物HN3可用于有机合成,其酸性与醋酸相似,若HN3与氨水混合,此反应的化学方程式是_______________________。
(5)若将0.4mol/LNH4Cl与0.2mol/LNaOH溶液等体积混合后,PH=10,下列关系正确的是(______)
A.c(NH4+)>c(OH-)>c(Na+)>c(NH3H2O) >c(H+)
B.c(NH4+)>c(Na+)>c(OH-)>c(NH3H2O) >c(H+)
C.c(NH4+)>c(Na+)>c(OH-)>c(H+)>c(NH3H2O)
D.c(NH4+)>c(Na+)>c(NH3H2O) >c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com