
ЁОЬтФПЁПФГЭЌбЇНјааSO2ЕФаджЪЪЕбщЁЃдкЕуЕЮАхaЁЂbЁЂcЁЂdДІЗжБ№ЕЮгаВЛЭЌЕФЪдМСЃЌдйЯђNa2SO3ЙЬЬхЩЯЕЮМгЪ§ЕЮХЈH2SO4КѓЃЌдкећИіЕуЕЮАхЩЯИЧЩЯХрбјУѓЃЌвЛЖЮЪБМфКѓЙлВьЕНЕФЪЕбщЯжЯѓШчБэЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
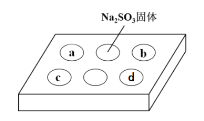
ађКХ | ЪдМС | ЪЕбщЯжЯѓ |
a | ЦЗКьШмвК | КьЩЋЭЪШЅ |
b | ЫсадKMnO4ШмвК | зЯЩЋЭЪШЅ |
c | NaOHШмвКЃЈКЌ2ЕЮЗгЬЊЃЉ | КьЩЋЭЪШЅ |
d | H2SШмвК | ЛЦЩЋЛызЧ |
A.дкХЈСђЫсгыNa2SO3ЙЬЬхЗДгІжаЃЌХЈСђЫсБэЯжЕФЧПбѕЛЏад
B.aЁЂbОљБэУїSO2ОпгаЦЏАзад
C.cжажЛПЩФмЗЂЩњЗДгІЃКSO2+2OH-=SO32-+H2O
D.dжаБэУїSO2ОпгабѕЛЏад
ЁОД№АИЁПD
ЁОНтЮіЁП
a.ЦЗКьШмвКЭЪЩЋЃЌЫЕУїSO2ОпгаЦЏАзадЃЛb.ЫсадИпУЬЫсМиШмвКЭЪЩЋЃЌЫЕУїSO2ОпгаЛЙдадЃЛc. ЕЮгаЗгЬЊЕФNaOHШмвКЭЪЩЋЫЕУїSO2ЮЊЫсадЦјЬхЃЛd. SO2гыЧтСђЫсЗДгІЩњГЩЛЦЩЋЕФSЕЅжЪЃЌЫЕУїЦфОпгабѕЛЏадЁЃ
A. ХЈСђЫсгыNa2SO3ЙЬЬхЗДгІжЦШЁSO2ЮЊИДЗжНтЗДгІЃЌВЛЩцМАбѕЛЏЛЙдЃЌAДэЮѓЃЛ
B. SO2ПЩвдЪЙЦЗКьЭЪЩЋЃЌЫЕУїЦфОпгаЦЏАзадЃЌSO2ЪЙЫсадИпУЬЫсМиШмвКЭЪЩЋЃЌЪЧгЩгкЦфЛЙдадЃЌBДэЮѓЃЛ
C. cжаПЩФмЗЂЩњSO2+2OH-=SO32-+H2OЃЌвВПЩФмЗЂЩњSO2+OH-=HSO3-ЃЌCДэЮѓЃЛ
D. SO2гыЧтСђЫсЗДгІЩњГЩЛЦЩЋЕФSЕЅжЪЃЌЫЕУїЦфОпгабѕЛЏадЃЌDе§ШЗЃЛ
ЙЪД№АИбЁDЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧІаюЕчГиЕФЙЄзїдРэЮЊЃКPb+PbO2+2H2SO=2PbSO4+2H2O

баЖСгвЭМЃЌЯТСаХаЖЯВЛе§ШЗЕФЪЧ
A.KБеКЯЪБЃЌdЕчМЋЗДгІЪНЃКPbSO4+2H2O-2e-=PbO2+4H++SO42-
B.ЕБЕчТЗжазЊвЦ0.2 molЕчзгЪБЃЌЂёжаЯћКФЕФ![]() ЮЊ0.2mol
ЮЊ0.2mol
C.KБеКЯЪБЃЌЂђжа![]() ЯђcЕчМЋЧЈвЦ
ЯђcЕчМЋЧЈвЦ
D.KБеКЯвЛЖЮЪБМфКѓЃЌЂђПЩЕЅЖРзїЮЊдЕчГиЃЌdЕчМЋЮЊе§МЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкееЯрЕзЦЌЕФЖЈгАЙ§ГЬжаЃЌЮДЦиЙтЕФфхЛЏвј(AgBr)ГЃгУСђДњСђЫсФЦ(Na2S2O3)ШмНтЃЌЗДгІЩњГЩNa3[Ag(S2O3)2]ЃЛдкЗЯЖЈгАвКжаМгШЫNa2SЪЙNa3[Ag(S2O3)2]жаЕФвјзЊЛЏЮЊAg2SЃЌВЂЪЙЖЈгАвКдйЩњЁЃНЋAg2SдкИпЮТЯТзЊЛЏЮЊAgЃЌОЭДяЕНСЫЛиЪевјЕФФПЕФЁЃ
(1)ЭЁЂвјЁЂН№дкдЊЫижмЦкБэжаЮЛгкЭЌвЛзхЯрСкжмЦкЃЌЛљЬЌвјдзгЕФзюЭтВуЕчзгХХВМЪНЮЊ _______ЁЃ
(2)NaЁЂOЁЂSМђЕЅРызгАыОЖгЩДѓЕНаЁЕФЫГађЮЊ______________________ЁЃ
(3)S2O32-РызгНсЙЙШчЭМЫљЪОЃЌЦфжааФСђдзгЕФдгЛЏЙьЕРРраЭЮЊ_______________________ЁЃ

(4)аДГіAgBr ШмгкNa2S2O3ШмвКЕФРызгЗДгІЗНГЬЪН______________ЁЃNa3[Ag(S2O3)2]жаДцдкЕФзїгУСІгаРызгМќЁЂЙВМлМќЁЂ______________ЁЃ
(5)дкПеЦјжазЦЩеAg2SЩњГЩAgКЭSO2ЃЌSO2 ЗжзгжаСђдзгЕФМлВуЕчзгЖдЪ§ЮЊ_________ЃЌЦфЗжзгПеМфЙЙаЭЮЊ______________ЁЃ SO2взШмгкЫЎЃЌдвђЪЧ________________________________ЁЃ
(6)ЯждкШЫУЧвбОгаЖржжЗНЗЈРДВтЖЈАЂЗќМгЕТТоГЃЪ§ЃЌXЩфЯпбмЩфЗЈОЭЪЧЦфжаЕФвЛжжЃЌЭЈЙ§ЖдН№ОЇЬхЕФX ЩфЯпбмЩфЭМЯѓЕФЗжЮіЃЌПЩвдЕУГіН№ОЇЬхЕФОЇАћЪєгкУцаФСЂЗНОЇАћ(гыЭЕФОЇАћЯрЫЦ)ЁЃШєН№дзгЕФАыОЖЮЊamЃЌН№ЕФУмЖШЮЊІбgЁЄcm-3ЃЌН№ЕФФІЖћжЪСПЮЊMgЁЄmol -1ЃЌЪдЭЈЙ§етаЉЪ§ОнСаГіМЦЫуАЂЗќМгЕТТоГЃЪ§ЕФЫуЪН______________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ8ЗжЃЉAЁЂBЁЂCЁЂDЫФжжЮяжЪжЎМфгаЯТЭМЫљЪОЕФзЊЛЏЙиЯЕЁЃвбжЊЃКAЪЧПеЦјжаЕФжївЊГЩЗжЃЌBЁЂCЁЂDОљЮЊЛЏКЯЮяЃЌЧвCЮЊКьзиЩЋЦјЬхЁЃ

ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉаДГіAКЭCЕФУћГЦЛђЛЏбЇЪНЃК A ЃЌC ЃЛ
ЃЈ2ЃЉдкЩЯЭМDЁњCЕФЙ§ГЬжаЃЌDБэЯжГіЧП ЃЈЬюЁАбѕЛЏадЁБЛђЁАЛЙдадЁБЃЉЃЛ
ЃЈ3ЃЉдкDЕФЯЁШмвКжаЕЮШыNaOHШмвКЃЌЦфЗДгІЕФРызгЗНГЬЪНЪЧ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПєЧЛљБтЬвЫсЪЧвЉЮяКЯГЩЕФживЊжаМфЬхЃЌЫќПЩгЩБНЗгКЭввШЉЫсЗДгІжЦЕУЃК
![]() +
+![]() Ёњ
Ёњ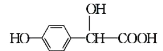
(ввШЉЫс) (єЧЛљБтЬвЫс)
ЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
A. ИУЗДгІЪЧШЁДњЗДгІ
B. ![]() КЭєЧЛљБтЬвЫсЛЅЮЊЭЌЯЕЮя
КЭєЧЛљБтЬвЫсЛЅЮЊЭЌЯЕЮя
C. 1ИієЧЛљБтЬвЫсЗжзгжазюЖрга17ИідзгЙВЦНУц
D. 1 molєЧЛљБтЬвЫсЗжзгзюЖрФмЗжБ№КЭ1 mol NaHCO3ЁЂ2 mol NaOHЁЂ3 mol NaЁЂ4 mol H2ЗЂЩњЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈЛђБэЪОЗНЗЈе§ШЗЕФЪЧ(ЁЁЁЁ)
A.ЕШжЪСПЕФСђеєЦјКЭСђЙЬЬхЗжБ№ЭъШЋШМЩеЃЌКѓепЗХГіЕФШШСПЖр
B.ЧтЦјЕФШМЩеШШЮЊ285.8 kJЁЄmolЃ1ЃЌдђЧтЦјШМЩеЕФШШЛЏбЇЗНГЬЪНЮЊ2H2(g)ЃЋO2(g)=2H2O(l)ЁЁІЄHЃНЃ285.8 kJЁЄmolЃ1
C.Ba(OH)2ЁЄ8H2O(s)ЃЋ2NH4Cl(s)= BaCl2(s)ЃЋ2NH3(g)ЃЋ10H2O(l)ЁЁІЄH<0
D.вбжЊжаКЭШШЮЊ57.3 kJЁЄmolЃ1ЃЌШєНЋКЌ0.5 mol H2SO4ЕФХЈШмвКгыКЌ1 mol NaOHЕФ ЯЁШмвКЛьКЯЃЌдђЗХГіЕФШШСПДѓгк57.3 kJ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊШШЛЏбЇЗНГЬЪНЃК
Ђй C2H2(g) +![]() O2(g) = 2CO2(g)ЃЋH2O(l) ІЄH1ЃН-1301.0 kJmol-1
O2(g) = 2CO2(g)ЃЋH2O(l) ІЄH1ЃН-1301.0 kJmol-1
Ђк C(s)+ O2(g) = CO2(g) ЁїH2ЃН-393.5 kJmol-1
Ђл H2(g)+![]() O2(g) = H2O(l) ЁїH3 = -285.8 kJЁЄmol-1
O2(g) = H2O(l) ЁїH3 = -285.8 kJЁЄmol-1
дђЗДгІЂм 2C(s)+ H2(g) = C2H2(g)ЕФЁїHЮЊ( )
A.+228.2 kJЁЄmol-1B.-228.2 kJЁЄmol-1
C.+1301.0 kJЁЄmol-1D.+621.7 kJЁЄmol-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУЯТЭМзАжУВтЖЈжаКЭШШЕФЪЕбщВНжшШчЯТЃК

ЂйгУСПЭВСПШЁ50 mL 0.25 mol/LСђЫсЕЙШыаЁЩеБжаЃЌВтГіСђЫсШмвКЮТЖШЃЛ
ЂкгУСэвЛСПЭВСПШЁ50 mL 0.55 mol/L NaOHШмвКЃЌВЂВтГіЦфЮТЖШЃЛ
ЂлНЋNaOHШмвКЕЙШыаЁЩеБжаЃЌЩшЗЈЪЙжЎЛьКЯОљдШЃЌВтГіЛьКЯвКзюИпЮТЖШЁЃ
ЛиД№ЯТСаЮЪЬтЃК
(1)ЕЙШыNaOHШмвКЕФе§ШЗВйзїЪЧ_________
AЃЎбиВЃСЇАєЛКТ§ЕЙШы BЃЎЗжШ§ДЮЩйСПЕЙШы CЃЎвЛДЮбИЫйЕЙШы
(2)ЪЙСђЫсгыNaOHШмвКЛьКЯОљдШЕФе§ШЗВйзїЪЧ__________
AЃЎгУЮТЖШМЦаЁаФНСАш BЃЎНвПЊгВжНЦЌгУВЃСЇАєНСАш CЃЎЧсЧсЕиеёЕДЩеБ DЃЎгУЬздкЮТЖШМЦЩЯЕФЛЗаЮВЃСЇАєЩЯЯТЧсЧсЕиГщЖЏ
(3)ЪЕбщЪ§ОнШчЯТБэЃК
ЮТЖШ ЪЕбщДЮЪ§ЁЁ | Ц№ЪМЮТЖШt1Ёц | жежЙЮТЖШt2/Ёц | ЮТЖШВюЦНОљжЕ (t2Ѓt1)/Ёц | ||
H2SO4 | NaOH | ЦНОљжЕ | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
ЂйИљОнБэжаЪ§ОнМЦЫуГіРДЮТЖШВюЕФЦНОљжЕЮЊ______ЁцЃЛ
ЂкНќЫЦШЯЮЊ0.55 mol/L NaOHШмвККЭ0.25 mol/LСђЫсШмвКЕФУмЖШЖМЪЧ1 g/cm3ЃЌжаКЭКѓЩњГЩШмвКЕФБШШШШнcЃН4.18 J/(gЁЄЁц)ЁЃдђжаКЭШШІЄHЃН_______( ШЁаЁЪ§ЕуКѓвЛЮЛ)ЁЃ
ЂлЩЯЪіЪЕбщЪ§жЕНсЙћгыжаКЭШШЮЊ57.3 kJ/molгаЦЋВюЃЌВњЩњЦЋВюЕФдвђПЩФмЪЧ____ЁЃ
aЃЎЪЕбщзАжУБЃЮТЁЂИєШШаЇЙћВю bЃЎгУЮТЖШМЦВтЖЈNaOHШмвКЦ№ЪМЮТЖШКѓжБНгВтЖЈH2SO4ШмвКЕФЮТЖШ cЃЎСПШЁNaOHШмвКЕФЬхЛ§ЪБбіЪгЖСЪ§ dЃЎЗжЖрДЮАбNaOHШмвКЕЙШыЪЂгаСђЫсЕФаЁЩеБжа
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдЕЮгаЗгЬЊЪдвКЕФЯТСаШмвКЃЌВйзїКѓбеЩЋБфЩюЕФЪЧ
A. УїЗЏШмвКМгШШ B. CH3COONaШмвКМгШШ
C. АБЫЎжаМгШыЩйСПNH4ClЙЬЬх D. аЁЫеДђШмвКжаМгШыЩйСПNaClЙЬЬх
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com