
【题目】已知热化学方程式:
① C2H2(g) +![]() O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJmol-1
③ H2(g)+![]() O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为( )
A.+228.2 kJ·mol-1B.-228.2 kJ·mol-1
C.+1301.0 kJ·mol-1D.+621.7 kJ·mol-1
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】已知A、B为单质,C为化合物。能实现上述转化关系的是( )
A+B![]() C
C![]() C溶液
C溶液![]() A+B
A+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显血红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①②B.③④C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种防止血栓形成与发展的药物J的合成路线如图所示(部分反应条件略去):
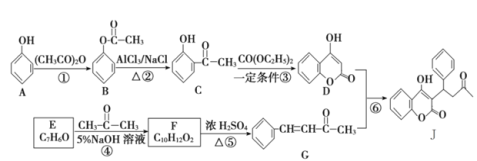
回答下列问题:
(1)A中官能团的名称是_________,反应⑤的反应类型是___________。
(2)J的分子式是__________。F的结构简式是_________。
(3)反应③的化学方程式为____________________________________。
(4)已知C有多种同分异构体。写出同时满足下列条件的C的同分异构体的结构简式__________。(只需写出两个)
①苯环上有两个处于对位上的取代基;
②1mol该有机物与足量金属钠反应生成1g氢气。
(5)请参照J的合成方法,完成下列合成路线:___________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行SO2的性质实验。在点滴板a、b、c、d处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如表所示。下列说法正确的是( )
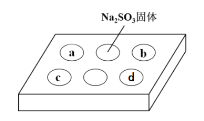
序号 | 试剂 | 实验现象 |
a | 品红溶液 | 红色褪去 |
b | 酸性KMnO4溶液 | 紫色褪去 |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
d | H2S溶液 | 黄色浑浊 |
A.在浓硫酸与Na2SO3固体反应中,浓硫酸表现的强氧化性
B.a、b均表明SO2具有漂白性
C.c中只可能发生反应:SO2+2OH-=SO32-+H2O
D.d中表明SO2具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验 步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验 现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu===2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。
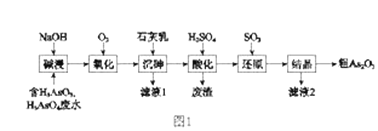
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。
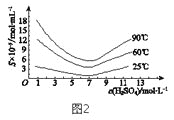
(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
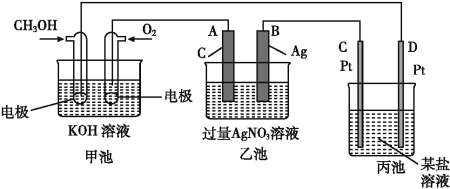
(1)C(Pt)电极的名称是____。
(2)写出通入O2的电极上的电极反应式:_______________。
(3)写出通入CH3OH的电极上的电极反应式:_________。
(4)若丙池是电解饱和食盐水溶液,在____(填“阳极”或“阴极”)附近滴入酚酞溶液变红。
(5)乙池中反应的化学方程式为____。
(6)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2____mL(标准状况下);若丙池中饱和食盐水溶液的体积为500 mL,电解后,溶液的pH=_____。(25 ℃,假设电解前后溶液的体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两套如图所示装置,分别为装置①和装置②,各盛有2g锌粒(颗粒大小相同)。
实验①:在装置①中加入40mL1mol/L的硫酸
实验②:在装置②中加入40mL4mol/L的硫酸。
比较二者收集10mLH2时所用的时间。
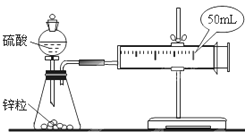
(1)当收集到10mLH2时,哪个实验所耗时间较长?__(填写实验序号)为什么?__。
(2)活塞外移的情况是__。
A.均匀外移 B.先快后慢 C.先慢后快 D.先慢后快,然后又逐渐减慢
你选择的理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )

A.用图甲装置模拟实验室进行石油的分馏实验
B.用图乙装置制取乙酸乙酯并除去其中的醋酸
C.用图丙装置可以检验溴乙烷与NaOH醇溶液共热产生的乙烯
D.用图丁装置分离苯和苯酚钠的水溶液,先从分液漏斗下口放出有机相
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com