
【题目】已知A、B为单质,C为化合物。能实现上述转化关系的是( )
A+B![]() C
C![]() C溶液
C溶液![]() A+B
A+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显血红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①②B.③④C.①③D.②④
【答案】D
【解析】
从A+B![]() C
C![]() C溶液
C溶液![]() A+B的转化关系可知,电解C溶液时,是电解电解质本身,因此C溶液中的溶质可以为不活泼金属的无氧酸盐或无氧酸;据此分析解答。
A+B的转化关系可知,电解C溶液时,是电解电解质本身,因此C溶液中的溶质可以为不活泼金属的无氧酸盐或无氧酸;据此分析解答。
①若A为钠,则B为氧气,则C为过氧化钠,C的水溶液为氢氧化钠,电解氢氧化钠得到氢气和氧气,不符合转化关系,故①错误;
②若C的溶液遇Na2CO3,放出CO2气体,则C可以为HCl、HBr、HI等,电解这些酸的水溶液实际上是电解溶质本身,在阴极得到氢气,故A可能是H2,B可能为卤素单质,故②符号上述转化关系,故②正确;
③若C的溶液中滴加KSCN溶液显红色,则C中含铁离子,电解铁盐不会得到铁单质,不符合转化关系,故③错误;
④由C的溶液中滴加NaOH溶液有蓝色沉淀生成,则C为铜盐,C可以为卤化铜,如氯化铜、溴化铜等,电解他们的水溶液都会得到铜和卤素单质,故B可以为铜,故④正确;
故选D。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,分别向20mL浓度均为xmol/L的NaCl和Na2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加过程中![]() 和
和![]() 与AgNO3溶液的体积关系如图所示。下列说法不正确的是
与AgNO3溶液的体积关系如图所示。下列说法不正确的是
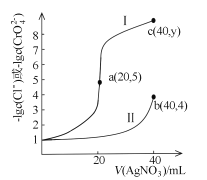
A.x =0.1B.曲线I代表NaCl溶液
C.Ksp(Ag2CrO4)约为4×10-12D.y=9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)C、N、O元素的第一电离能大小为:_________。
(2)Cu的价电子排布式为______,基态Fe原子有_____个未成对电子,Fe3+的价电子排布图为________。
(3)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为______。S8易溶于二硫化碳的原因是_________。
![]()
(4)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:

(a)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(b)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于______晶体。
(c)如图2所示,每条折线表示周期表ⅣA到ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___。判断依据____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO=2PbSO4+2H2O

研读右图,下列判断不正确的是
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的![]() 为0.2mol
为0.2mol
C.K闭合时,Ⅱ中![]() 向c电极迁移
向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
A. SO2是直线形分子B. SO3是三角锥形分子
C. BF3的键角为120°D. PCl3是平面三角形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的4位科学家,其研究对象之一为“分子开关”,即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图I所示)可用于ⅢB族元素对应的离子萃取,如La2+、Sc2+。写出基态二价钪离子的核外电子排布式____。

(2)对于叔丁基杯[4]芳烃由4个羟基构成杯底,羟基中氧原子的杂化方式为____,羟基间的相互作用力为_____。
(3)已知C60分子结构和C60晶胞示意图如图所示:
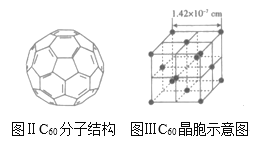
则1个C60分子中含有的![]() 键个数为_____,与1个C60分子距离最近且相等的C60分子有_____个,C60晶体的密度为_____gcm3(写出表达式)。
键个数为_____,与1个C60分子距离最近且相等的C60分子有_____个,C60晶体的密度为_____gcm3(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.20g46%甲酸(HCOOH)水溶液所含的氧原子数为NA
B.标准状况下,18g冰水中共价键的数目为NA
C.5.6g铁与7.1gCl2充分反应,转移电子数目为0.3NA
D.7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加人Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、金在元素周期表中位于同一族相邻周期,基态银原子的最外层电子排布式为 _______。
(2)Na、O、S简单离子半径由大到小的顺序为______________________。
(3)S2O32-离子结构如图所示,其中心硫原子的杂化轨道类型为_______________________。

(4)写出AgBr 溶于Na2S2O3溶液的离子反应方程式______________。Na3[Ag(S2O3)2]中存在的作用力有离子键、共价键、______________。
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2 分子中硫原子的价层电子对数为_________,其分子空间构型为______________。 SO2易溶于水,原因是________________________________。
(6)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图象的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol -1,试通过这些数据列出计算阿伏加德罗常数的算式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
① C2H2(g) +![]() O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJmol-1
③ H2(g)+![]() O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为( )
A.+228.2 kJ·mol-1B.-228.2 kJ·mol-1
C.+1301.0 kJ·mol-1D.+621.7 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com