
【题目】两套如图所示装置,分别为装置①和装置②,各盛有2g锌粒(颗粒大小相同)。
实验①:在装置①中加入40mL1mol/L的硫酸
实验②:在装置②中加入40mL4mol/L的硫酸。
比较二者收集10mLH2时所用的时间。
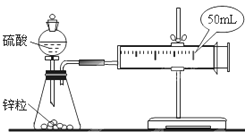
(1)当收集到10mLH2时,哪个实验所耗时间较长?__(填写实验序号)为什么?__。
(2)活塞外移的情况是__。
A.均匀外移 B.先快后慢 C.先慢后快 D.先慢后快,然后又逐渐减慢
你选择的理由是__。
【答案】实验① 因为浓度小的反应速度慢 D 此反应是放热反应,温度升高,反应速度加快;随反应的进行,H+浓度不断减小,反应速度减慢
【解析】
(1)根据物质的量浓度对反应速率的影响进行分析解答;
(2)锌与稀硫酸的反应为放热反应,开始时温度对反应速率影响较大,之后氢离子浓度减小,则浓度对反应速率影响较大,据此分析解答。
(1)由于浓度越大,反应速率越快,则4mol/L的硫酸与锌反应的速率比1mol/L的硫酸反应快,则收集10mL氢气时,1mol/L的硫酸需要的时间长,故答案为:实验①;因为浓度小的反应速度慢;
(2)由于该反应是放热反应,温度升高,反应速度加快,开始时温度对反应速率影响较大,之后随反应的进行,H+浓度不断减小,浓度对反应速率影响较大,则反应速度减慢,所以活塞外移的情况是先慢后快,然后又逐渐减慢,故答案为:D;此反应是放热反应,温度升高,反应速度加快,随反应的进行,H+浓度不断减小,反应速度减慢。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加人Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、金在元素周期表中位于同一族相邻周期,基态银原子的最外层电子排布式为 _______。
(2)Na、O、S简单离子半径由大到小的顺序为______________________。
(3)S2O32-离子结构如图所示,其中心硫原子的杂化轨道类型为_______________________。

(4)写出AgBr 溶于Na2S2O3溶液的离子反应方程式______________。Na3[Ag(S2O3)2]中存在的作用力有离子键、共价键、______________。
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2 分子中硫原子的价层电子对数为_________,其分子空间构型为______________。 SO2易溶于水,原因是________________________________。
(6)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图象的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol -1,试通过这些数据列出计算阿伏加德罗常数的算式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
① C2H2(g) +![]() O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJmol-1
③ H2(g)+![]() O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为( )
A.+228.2 kJ·mol-1B.-228.2 kJ·mol-1
C.+1301.0 kJ·mol-1D.+621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是_________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是__________
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒上下轻轻地抽动
(3)实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①根据表中数据计算出来温度差的平均值为______℃;
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_______( 取小数点后一位)。
③上述实验数值结果与中和热为57.3 kJ/mol有偏差,产生偏差的原因可能是____。
a.实验装置保温、隔热效果差 b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 c.量取NaOH溶液的体积时仰视读数 d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
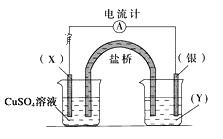
请回答下列问题:
(1)电极X的材料是__,电解质溶液Y是__;
(2)银电极为电池的__极,发生的电极反应为__;
(3)X电极上发生的电极反应为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2 (g) +6H2 (g) ![]() C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是

A. 该反应的△H<0
B. 曲线b代表H2O
C. N点和M点所处状态的c(H2)不一样
D. 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置及用途叙述完全正确的是
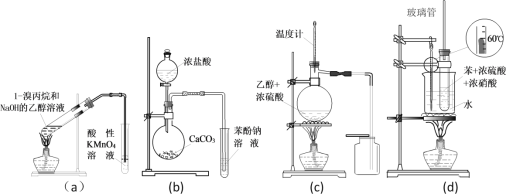
A. a装置检验消去反应后有丙烯生成
B. b装置检验酸性:盐酸>碳酸>苯酚
C. c装置用于实验室制取并收集乙烯
D. d装置用于实验室制硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
2NO+O2在恒容密闭容器中反应,不能判断此反应达到最大限度的标志是( )
A. 单位时间内生成n mol O2 的同时,生成2n molNO2 B. 混合气体的平均相对分子质量不再改变
C. 混合气体的颜色不再改变 D. NO2, NO, O2的速率之比是2:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com