
【题目】依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
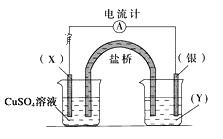
请回答下列问题:
(1)电极X的材料是__,电解质溶液Y是__;
(2)银电极为电池的__极,发生的电极反应为__;
(3)X电极上发生的电极反应为__。
【答案】Cu AgNO3溶液 正 Ag++e- =Ag Cu-2e- =Cu2+
【解析】
根据反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s),在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应式为Cu-2e-=Cu2+,则正极为Ag,Ag+在正极上得电子被还原,电极反应式为Ag++e=Ag,电解质溶液为AgNO3,结合原电池原理分析解答。
(1)由反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液应该为AgNO3,故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应式为Ag++e- =Ag,故答案为:正;Ag++e- =Ag;
(3)Cu被氧化,失电子,应为原电池的负极,电极反应式为Cu-2e- =Cu2+,故答案为:Cu-2e- =Cu2+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对下列化学用语的理解和描述均正确的是
A. 电子式![]() 可以表示羟基.也可以表示氢氧根离子
可以表示羟基.也可以表示氢氧根离子
B. 填充模型![]() 可以表示二氧化碳分子,也可以表示水分子
可以表示二氧化碳分子,也可以表示水分子
C. 原子结构示意图![]() 可以表示12C,也可以表示14C
可以表示12C,也可以表示14C
D. 结构示意图为![]() 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验 步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验 现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu===2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
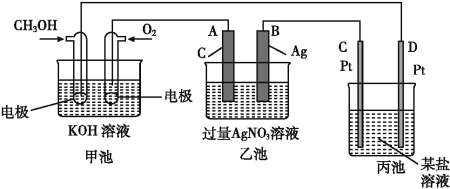
(1)C(Pt)电极的名称是____。
(2)写出通入O2的电极上的电极反应式:_______________。
(3)写出通入CH3OH的电极上的电极反应式:_________。
(4)若丙池是电解饱和食盐水溶液,在____(填“阳极”或“阴极”)附近滴入酚酞溶液变红。
(5)乙池中反应的化学方程式为____。
(6)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2____mL(标准状况下);若丙池中饱和食盐水溶液的体积为500 mL,电解后,溶液的pH=_____。(25 ℃,假设电解前后溶液的体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A~I的元素中选择符合题意的元素,按要求回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)只有负价而无正价的是______(填元素名称);
(2)最高价氧化物的水化物酸性最强的是____(填化学式);
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物的结构式 _____;
(4)在B、C、D、J、 E、F、G、H中,原子半径最大的是____(填原子符号);
(5)画出上述元素中金属性最强的元素的原子结构示意图______;
(6)C单质与氢氧化钠溶液反应的离子方程式________________________;
(7)用电子式表示E单质的形成过程_______________________
(8)写出冶炼B单质的化学方程式____________________;
(9)D的最简单氢化物的燃烧热为890.3 kJ/mol,写出D的最简单氢化物燃烧热的热化学方程式_____;
(10)写出NaHSO4熔融时电离方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两套如图所示装置,分别为装置①和装置②,各盛有2g锌粒(颗粒大小相同)。
实验①:在装置①中加入40mL1mol/L的硫酸
实验②:在装置②中加入40mL4mol/L的硫酸。
比较二者收集10mLH2时所用的时间。
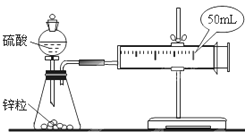
(1)当收集到10mLH2时,哪个实验所耗时间较长?__(填写实验序号)为什么?__。
(2)活塞外移的情况是__。
A.均匀外移 B.先快后慢 C.先慢后快 D.先慢后快,然后又逐渐减慢
你选择的理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
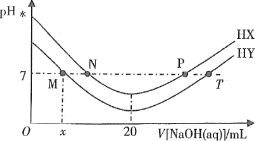
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩10种元素在周期表中的位置。
族 周期 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,金属性最强的是(填元素符号,下同)________,③④⑤三种元素的原子半径由大到小的顺序是____________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式)
(3)元素⑥的氢化物的电子式为____________,该氢化物与元素⑥的最高价氧化物对应的水化物反应的化学方程式为____________。
(4)比较⑥和⑦氢化物的稳定性由强到弱的顺序是____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.11 g硫化钾和过氧化钾的混合物,含有的离子数目为0.4NA
B.28 g聚乙烯(![]() )含有的质子数目为16NA
)含有的质子数目为16NA
C.将标准状况下224 mL SO2溶于水制成100 mL溶液,H2SO3、![]() 、
、![]() 三者数目之和为0.01NA
三者数目之和为0.01NA
D.含63 g HNO3的浓硝酸与足量铜完全反应,转移电子数目为0.50NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com