
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且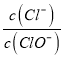 的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后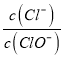 =11,则溶液中
=11,则溶液中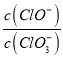 =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n的范围:![]() a mol ≤ n(e -)≤
a mol ≤ n(e -)≤![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 ![]() a mol
a mol
【答案】D
【解析】
A.假设n(ClO-)=1mol,则n(Cl-)=11mol,根据电子转移守恒计算n(ClO3-);
B.根据元素的原子守恒分析解答;
C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5n(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH);氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),进而计算转移电子物质的量范围;
D.氧化产物只有KClO3时,其物质的量最大,由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),结合电子转移守恒计算。
A.假设n(ClO-)=1mol,由于反应后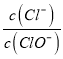 =11,则n(Cl-)=11mol,根据电子转移守恒可得5n(ClO3-)+n(ClO-)= n(Cl-),5×n(ClO3-)=11mol-1mol=10mol,所以n(ClO3-)=2mol,故溶液中
=11,则n(Cl-)=11mol,根据电子转移守恒可得5n(ClO3-)+n(ClO-)= n(Cl-),5×n(ClO3-)=11mol-1mol=10mol,所以n(ClO3-)=2mol,故溶液中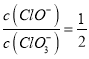 ,A正确;
,A正确;
B.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+ n(KClO)+n(KClO3)=n(KOH),两式联立可得n(Cl2)=![]() n(KOH)=
n(KOH)=![]() ×a mol=
×a mol=![]() a mol,B正确;
a mol,B正确;
C.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5n(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=![]() n(KOH)=
n(KOH)=![]() ×a mol=
×a mol=![]() a mol;转移电子最大物质的量为:
a mol;转移电子最大物质的量为:![]() a mol×5=
a mol×5=![]() a mol;
a mol;
氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),所以有n(KClO)=![]() n(KOH)=
n(KOH)=![]() ×a mol=
×a mol=![]() a mol,转移电子最小物质的量=
a mol,转移电子最小物质的量=![]() ×a mol×1=
×a mol×1=![]() a mol,则反应中转移电子的物质的量n(e-)的范围为:
a mol,则反应中转移电子的物质的量n(e-)的范围为:![]() a mol ≤ n(e -)≤
a mol ≤ n(e -)≤![]() a mol,C正确;
a mol,C正确;
D.氧化产物只有KClO3时,其物质的量最大,根据电子转移守恒n(KCl)=5n(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n最大(KClO3)=![]() n(KOH)=
n(KOH)=![]() ×a mol=
×a mol=![]() a mol,D错误;
a mol,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】黄铜矿、辉铜矿、斑铜矿等是工业炼铜的常用原料。完成下列计算:
(1)某种黄铜矿中铜的质量分数为0.25,生产1吨纯铜理论上需要这种铜矿_______吨。
(2)实验室以黄铜矿为原料模拟工业炼铜时会产生SO2,用200 mL 1 mol/L的NaOH溶液吸收后,将溶液低温蒸干,得到不含结晶水的固体19.98 g,求所得固体的成分及物质的量。__________
(3)斑铜矿的主要成分M由Cu、Fe、S三种元素组成,其中Cu、Fe元素的质量比为40∶7。常温下将5.04 g M粉末全部溶于过量浓HNO3中,反应后的溶液加水稀释至500 mL,测得其pH=0。向溶液中滴加5 mol/L的NaOH溶液,当加入126 mL后,沉淀质量不再增加,求M的化学式。__________
(4)以辉铜矿为原料火法炼铜,其原理是:
2Cu2S+3O2 → 2Cu2O+2SO2; Cu2S+2Cu2O → 6Cu+SO2↑。
将含3 mol Cu2S的辉铜矿与一定量的空气(氮气、氧气的体积比为4:1)在密闭容器中充分反应(假设各步反应都完全),得到单质铜3 mol,求所得气体中SO2的体积分数。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料。完成下列填空:
(1)将0.050mol SO2(g) 和0.030mol O2(g) 充入一个2L的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g)+Q 。经2分钟反应达到平衡,测得n(SO3) = 0.040mol,则O2的平均反应速率为______________________。
2SO3(g)+Q 。经2分钟反应达到平衡,测得n(SO3) = 0.040mol,则O2的平均反应速率为______________________。
(2)在容积不变时,下列措施中有利于提高SO2平衡转化率的有________(选填编号)。
a.移出氧气
b.降低温度
c.减小压强
d.再充入0.050molSO2(g)和0.030molO2(g)
(3)在起始温度T1(673K)时SO2的转化率随反应时间(t)的变化如图。请在图中画出其他条件不变情况下,起始温度为T2(723K)时SO2的转化率随反应时间变化的示意图。________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是( )
2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是( )
A.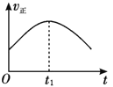 B.
B.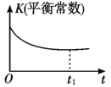
C. D.
D.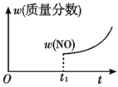
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化汞(HgCl2)可用于木材和解剖标本的保存、皮革鞣制和钢铁镂蚀,是分析化学的重要试剂,还可做消毒剂和防腐剂。HgCl2在水中稍有水解:HgCl2+H2O![]() Hg(OH)Cl+HCl
Hg(OH)Cl+HCl
(1)为了抑制上述反应中HgCl2的水解,可以采取的措施是_________。(选填编号)
a.加水稀释 b. 增加HCl的浓度 c.及时移走产物 d.降温
(2)HgCl2与稀氨水反应则生成难溶解的氨基氯化汞,化学方程式为HgCl2+2NH3→Hg(NH2)Cl↓+NH4Cl,上述反应的短周期元素中,非金属性最强元素原子的最外层轨道排布式为__________,该原子核外电子云有_________种不同的伸展方向。
(3)已知PCl3与NH3分子结构相似,PCl3的电子式是_______________;PCl3与NH3的沸点比较,______高,其原因是_______________________。
(4)氮的一种氢化物HN3可用于有机合成,其酸性与醋酸相似,若HN3与氨水混合,此反应的化学方程式是_______________________。
(5)若将0.4mol/LNH4Cl与0.2mol/LNaOH溶液等体积混合后,PH=10,下列关系正确的是(______)
A.c(NH4+)>c(OH-)>c(Na+)>c(NH3H2O) >c(H+)
B.c(NH4+)>c(Na+)>c(OH-)>c(NH3H2O) >c(H+)
C.c(NH4+)>c(Na+)>c(OH-)>c(H+)>c(NH3H2O)
D.c(NH4+)>c(Na+)>c(NH3H2O) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(![]() )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物Ⅰ的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物Ⅰ的一种合成路线:
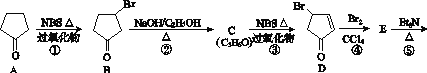
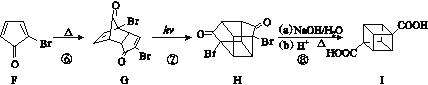
回答下列问题:
(1)C的结构简式为______________,E的结构简式为______________。
(2)③的反应类型为______________,⑤的反应类型为______________。
(3)化合物A可由环戊烷经三步反应合成:
![]()
反应1的试剂与条件为________;反应2的化学方程式为_______________;反应3可用的试剂为________。
(4)在合成I物质的路线中,互为同分异构体的化合物是________(填化合物代号)。
(5)立方烷经硝化可得到六硝基立方烷,其可能的结构有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含铬Cr2O72- 废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3(Cr化合价+3价) 。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(2-x)molB.处理废水中Cr2O72- 的物质的量为![]() mol
mol
C.反应中发生转移的电子为3nx molD.在FeO·FeyCrxO3中3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过如图所示的流程由甲苯氧化制备苯甲醛。
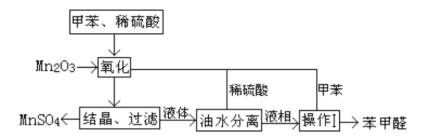
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是___。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的___。
(3)实验过程中,可循环使用的物质分别为___,___。
(4)实验中分离甲苯和苯甲醛采用的操作I是___________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表),
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com